از اسید و الکل تا استر: آموزش واکنش استری شدن و پلیمریزاسیون

واکنش استری شدن یکی از جذابترین و کاربردیترین مباحث در شیمی آلی است. این واکنش نه تنها پایهای برای درک تشکیل بسیاری از مواد روزمره است، بلکه دریچهای به دنیای وسیع پلیمرها و صنایع شیمیایی مدرن باز میکند. در این مقاله از سایت تدریس شیمی متین هوشیار، به زبانی ساده و گامبهگام، به بررسی این واکنش مهم از فصل سوم شیمی یازدهم میپردازیم.
شما خواهید آموخت که چگونه از ترکیب یک اسید کربوکسیلیک و یک الکل، استر تشکیل میشود و چگونه این فرآیند ساده میتواند به تولید پلیمرهای پیچیدهای مانند پلیاستر منجر شود. با درک این مکانیسم، نه تنها به سوالات کتاب درسی پاسخ خواهید داد، بلکه کاربردهای گسترده آن را در صنعت و زندگی روزمره درک خواهید کرد.
این مقاله با ارائه مثالهای ملموس، تصاویر گویا و توضیحات واضح، طراحی شده است تا شما را از حفظ کردن طوطیوار مطالب بینیاز کند و به درک عمیق و پایدار از موضوع برساند. هدف ما این است که پس از خواندن این مقاله، به راحتی بتوانید واکنش استری شدن را ترسیم کنید، محصولات آن را پیشبینی کنید و اهمیت آن را در دنیای اطراف خود توضیح دهید.
واکنش استری شدن چیست؟
واکنش استری شدن یک واکنش شیمیایی بنیادی و مهم بین یک اسید کربوکسیلیک و یک الکل است. در این واکنش، این دو ماده تحت شرایط مناسب با یکدیگر ترکیب میشوند و با از دست دادن یک مولکول آب، ترکیبی جدید به نام استر را میسازند. استرها دستهای از ترکیبات آلی با طیف گستردهای از رایحهها و کاربردها هستند که درک این واکنش کلید شناخت دنیای آنهاست.
این فرآیند که به واکنش فیشر نیز معروف است، نه تنها از نظر علمی جذاب است، بلکه پایه و اساس بسیاری از صنایع شیمیایی مدرن را تشکیل میدهد. از تولید عطرها و طعمدهندههای غذایی گرفته تا ساخت پلیمرهای مقاوم مانند پلیاستر، همگی بر همین واکنش ساده اما قدرتمند متکی هستند. بنابراین، یادگیری دقیق آن برای هر دانش آموز تجربی و ریاضی ضروری محسوب میشود.
درک این واکنش به شما کمک میکند تا بتوانید محصول حاصل از ترکیب انواع اسیدها و الکلها را پیشبینی کنید. این پیشبینی اولین گام برای طراحی و سنتز مواد مورد نیاز در صنعت است. در ادامه، به بررسی دقیقتر مکانیسم این واکنش و یک مثال عملی از آن میپردازیم.
مکانیسم واکنش استری شدن
مکانیسم واکنش استری شدن به این صورت است که گروه هیدروکسیل (OH-) از مولکول الکل و گروه هیدروژن (H+) از گروه کربوکسیل (COOH) اسید جدا میشوند. این دو گروه حذف شده، با یکدیگر ترکیب شده و یک مولکول آب (H₂O) را تشکیل میدهند. در نهایت، بخشهای باقیمانده از اسید و الکل از طریق یک پیوند کووالانسی به هم متصل شده و مولکول استر را به وجود میآورند.
برای درک بهتر این مکانیسم، میتوان آن را به زبان ساده اینگونه بیان کرد: اسید و الکل مانند دو دوست هستند که برای دست دادن به هم نزدیک میشوند. اما هر کدام یک دست خود (یک اتم هیدروژن و یک گروه هیدروکسیل) را کنار میگذارند تا با هم یک مولکول آب بسازند. پس از این کار، آنها با دستان باقیمانده به هم متصل میشوند و یک ترکیب جدید (استر) را تشکیل میدهند.
این فرآیند معمولاً به حضور یک کاتالیزور اسیدی مانند اسید سولفوریک غلیظ نیاز دارد. کاتالیزور سرعت واکنش را افزایش میدهد و به انجام بهتر آن کمک میکند. معادله زیر به صورت شماتیک این مکانیسم را نشان میدهد.
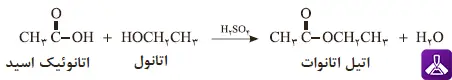
مثال عملی: تولید اتیل استات از اتانول و استیک اسید
یک مثال کلاسیک و ساده از واکنش استری شدن، تولید اتیلاستات از واکنش اسید استیک (یا اتانوئیک اسید) با اتانول است. اتیلاستات مایعی فرار با بوی شیرین و مطبوع است که به عنوان حلال در صنایع رنگ، رزین و حتی لاک پاککن استفاده میشود. معادله این واکنش شیمیایی به صورت زیر است:
این واکنش یک تعادل شیمیایی است. برای بهدست آوردن بازدهی بالا و تولید مقدار بیشتری استر، اغلب از یک کاتالیزور اسیدی استفاده میکنند یا یکی از محصولات (مانند آب) را از محیط واکنش خارج مینمایند. این عمل طبق اصل لوشاتلیه، تعادل را به سمت تولید محصول بیشتر جابهجا میکند.
این مثال به خوبی نشان میدهد که چگونه از ترکیب دو ماده نسبتاً ساده، میتوان یک محصول با ارزش و پرکاربرد صنعتی تولید کرد. در مقیاس آزمایشگاهی، میتوان بوی مشخص اتیلاستات را پس از انجام واکنش حس کرد که نشاندهنده موفقیتآمیز بودن فرآیند است.
کاربردهای استرها در زندگی روزمره
استرها تنها به کتابهای درسی شیمی محدود نمیشوند؛ آنها به شکلهای گوناگون، هر روز در کنار ما هستند و بخشی از زندگی روزمره ما را شکل میدهند. بسیاری از رایحههای میوههایی که دوست داریم و عطرهای خوشبویی که استفاده میکنیم، از ترکیبات استری تشکیل شدهاند. این ترکیبات با تقلید از طعمها و بوهای طبیعی، دنیای صنایع غذایی و عطرسازی را متحول کردهاند.
علاوه بر عطر و طعم، استرها در تولید محصولات مهم دیگری نیز نقش اساسی دارند. به عنوان مثال، از برخی استرها به عنوان نرمکننده در ساخت پلاستیکها استفاده میشود تا انعطافپذیری بیشتری داشته باشند. همچنین، آنها پایه اصلی بسیاری از حلالهای صنعتی، لاکها و حتی داروها هستند. این تنوع کاربرد، نشاندهنده اهمیت فوقالعاده این دسته از ترکیبات شیمیایی است.
درک این کاربردها به ما کمک میکند تا بفهمیم چرا یادگیری واکنش استری شدن تنها یک مبحث تئوری نیست، بلکه یک ضرورت علمی برای درک دنیای اطراف ما است. در ادامه، به یکی از مهمترین کاربردهای صنعتی استرها، یعنی تولید اتیل بوتانوات و استفاده از آن در صنعت شوینده میپردازیم.
تولید صنعتی استرها: اتیل بوتانوات و شویندهها
یکی از جذابترین نمونههای تولید صنعتی استرها، سنتز اتیل بوتانوات است. این استر به دلیل دارا بودن بوی مشخص و شیرین آناناس، به طور گستردهای در صنایع غذایی و عطرسازی مورد استفاده قرار میگیرد. اما کاربرد آن به همینجا ختم نمیشود؛ از این ترکیب در تولید شویندهها و مواد شوینده معطر نیز استفاده میشود تا حس تازگی و تمیزی را به مصرفکننده القا کند.
اتیل بوتانوات از واکنش استری شدن بین اسید بوتانوئیک (با چهار اتم کربن) و اتانول تولید میشود. این واکنش در مقیاس صنعتی و با استفاده از کاتالیزورهای مناسب برای دستیابی به بازدهی بالا انجام میپذیرد. معادله ساده شده این واکنش به صورت زیر است:
استفاده از این استر در شویندهها یک مثال عالی از پیوند شیمی و زندگی روزمره است. وقتی شما بوی آناناس را از یک شوینده استشمام میکنید، در واقع دارید رایحه یک استر را حس میکنید که حاصل یک واکنش شیمیایی برنامهریزی شده است. این موضوع به وضوح اهمیت واکنش استری شدن را در صنایع شیمیایی نوین نشان میدهد.
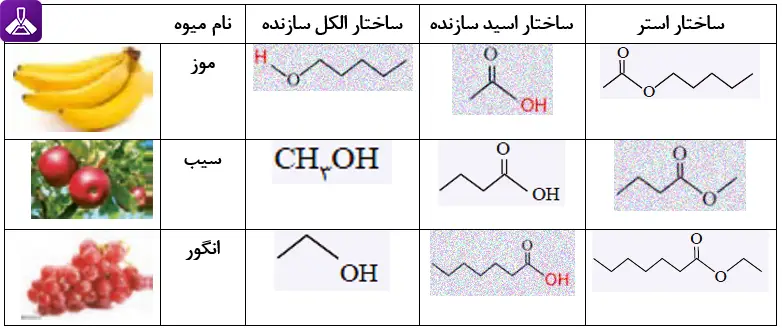
خود را بیازمایید صفحه 115 شیمی یازدهم
با رسم ساختار الكل و اسید سازنده برای هر استر، جدول زیر را كامل كنید.
جواب:
پلیمریزاسیون و تشکیل پلیاستر
واکنش استری شدن میتواند از تولید یک مولکول استر ساده فراتر رود و به دنیای شگفتانگیز پلیمرها وارد شود. هنگامی که به جای اسیدها و الکلهای ساده، از ترکیباتی با دو گروه عاملی استفاده کنیم، واکنش میتواند از دو طرف ادامه یابد. این فرآیند که به آن پلیمریزاسیون تراکمی میگویند، منجر به تشکیل مولکولهای بسیار بزرگ و زنجیرهای به نام پلیاستر میشود.
پلیاسترها یکی از پرکاربردترین پلیمرهای مصنوعی در جهان هستند که از به هم پیوستن تعداد زیادی واحد استری تشکیل شدهاند. استحکام، مقاومت شیمیایی و انعطافپذیری این مواد، آنها را به انتخاب اول برای تولید الیاف پارچه، بطریهای نوشیدنی، فیلمهای بستهبندی و هزاران محصول دیگر تبدیل کرده است. درک چگونگی تشکیل این زنجیرهها، درک یکی از باشکوهترین دستاوردهای شیمی آلی است.
فرآیند تشکیل پلیاستر یک واکنش گام به گام است که در آن هر مرحله، امکان ادامه واکنش را برای مولکول فراهم میکند. این ویژگی به دلیل وجود گروههای عاملی فعالی است که حتی پس از تشکیل یک پیوند استری، همچنان در مولکول باقی میمانند. در ادامه، این فرآیند را به طور دقیقتر و مرحله به مرحله بررسی خواهیم کرد.
واکنش کربوکسیلیک اسید دو عاملی با الکل دو عاملی
فرآیند تشکیل پلیاستر با واکنش بین یک اسید کربوکسیلیک دو عاملی (دارای دو گروه COOH) و یک الکل دو عاملی (دارای دو گروه OH) آغاز میشود. برای مثال، اسید ترفتالیک (با دو گروه COOH) و اتیلن گلیکول (با دو گروه OH) دو مونومر رایج برای این واکنش هستند. در مرحله نخست، یک گروه هیدروکسیل از الکل با یک گروه کربوکسیل از اسید واکنش میدهد.
نتیجه این واکنش، تشکیل یک مولکول دیاستر و آزاد شدن یک مولکول آب است. اما نکته کلیدی اینجاست که این مولکول جدید، هنوز یک گروه کربوکسیل و یک گروه هیدروکسیل آزاد دارد. این گروههای عاملی فعال، همچنان آماده هستند تا با گروههای عاملی روی مولکولهای دیگر واکنش دهند (شکل 14_الف)
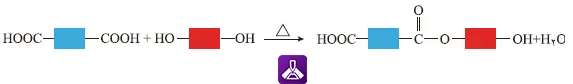
شکل 14_الف الگویی از واكنش استری شدن بین کربوکسیلیک اسید و الكل دو عاملی
این طراحی هوشمندانه مونومرهای دو عاملی است که به واکنش اجازه میدهد به صورت زنجیرهای و از دو طرف ادامه یابد. هر مونومر مانند یک «اتصالدهنده دوطرفه» عمل میکند که میتواند به دو مونومر دیگر متصل شود و به این ترتیب، زنجیره رشد کند.
نقش گروههای عاملی در ادامه واکنش
مهمترین عامل برای ادامه یافتن واکنش و تشکیل زنجیره پلیمری، وجود گروههای عاملی انتهایی فعال روی مولکولها است. پس از تشکیل اولین پیوند استری، مولکول حاصل (دیمر) هنوز دارای یک گروه کربوکسیل (COOH) و یک گروه هیدروکسیل (OH) است. این گروهها دقیقاً مشابه گروههای عاملی روی مونومرهای اولیه هستند.
بنابراین، این دیمر میتواند دقیقاً مانند یک مونومر رفتار کند. گروه کربوکسیل آزاد آن میتواند با گروه OH یک الکل دو عاملی دیگر واکنش دهد و گروه هیدروکسیل آزاد آن نیز میتواند با گروه COOH یک اسید دو عاملی دیگر پیوند تشکیل دهد. این ویژگی، امکان اتصال بیپایان مولکولها به یکدیگر را فراهم میسازد.
این فرآیند به صورت تصاعدی ادامه مییابد. هر مولکول جدیدی که تشکیل میشود، خود دارای دو گروه عاملی فعال است و میتواند به دو مولکول دیگر متصل شود. این چرخه بارها و بارها تکرار میشود تا زمانی که یا مونومرها تمام شوند یا شرایط واکنش تغییر کند.
تشکیل زنجیره بلند پلیاستر
با ادامه یافتن چرخه واکنشهای استری شدن، مولکولهای کوچک و ساده (مونومرها) به تدریج به هم میپیوندند و مولکولهای بزرگتر و بزرگتری را تشکیل میدهند. ابتدا دیمر (۲ واحد)، سپس تریمر (۳ واحد)، الیگومر (چند واحد) و در نهایت یک پلیمر با زنجیرهای بسیار بلند و شامل هزاران واحد مونومر به دست میآید.
این زنجیره بلند پلیاستر، پر از پیوندهای استری است که به صورت متناوب در طول زنجیره تکرار میشوند. به همین دلیل به این دسته از پلیمرها، پلیمرهای تراکمی میگویند؛ زیرا در حین تشکیل، یک مولکول کوچک (معمولاً آب) کندانس و حذف میشود. ساختار نهایی پلیمر به نوع مونومرهای به کار رفته بستگی دارد و خواص فیزیکی متفاوتی مانند استحکام، انعطاف یا شفافیت را ایجاد میکند.
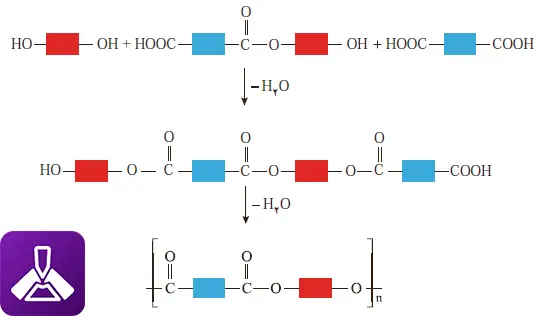
شکل 14_ ب الگوی واکنش تشکیل پلی استر
محصول نهایی این واکنش زنجیرهای، دیگر یک مولکول کوچک با بوی میوه نیست، بلکه یک ماده جامد با کاربردهای صنعتی بسیار گسترده است. این دگرگونی از مولکولهای کوچک به یک ماده درشتمولکول، زیبایی و قدرت شیمی آلی را به نمایش میگذارد.
رابطه ساختار و خواص در پلیاسترها
ویژگیها و رفتار هر مادهای مستقیماً به ساختار مولکولی آن وابسته است و پلیاسترها نیز از این قاعده مستثنی نیستند. ساختار شیمیایی پلیاسترها تعیینکننده اصلی خواص فیزیکی و مکانیکی آنها است. در رابطه با ساختار شیمیایی میتوان به نوع مونومرهای اسید و الکل مورد استفاده، طول زنجیره پلیمری و آرایش فضایی مولکولها اشاره کرد. برای مثال، هرچه زنجیرههای پلیمری طولانیتر و دارای آرایش منظمتری باشند، استحکام و دمای ذوب بالاتری خواهند داشت.
این رابطه ساختار-خواص به شیمیدانان این قدرت را میدهد که پلیاسترها را «طراحی» کنند. با انتخاب عمدی مونومرهای خاص و کنترل شرایط واکنش، میتوان پلیمری با ویژگیهای دقیقاً مطابق با نیاز تولید کرد. آیا به یک پلیمر انعطافپذیر برای تولید لباس نیاز دارید؟ یا یک پلیمر سفت و سخت برای ساخت قطعات خودرو؟ پاسخ در انتخاب هوشمندانه اجزای سازنده و کنترل فرآیند پلیمریزاسیون نهفته است.
این تنوع ساختاری منجر به تولید خانوادهای بزرگ و متنوع از پلیاسترها با کاربردهای کاملاً متفاوت شده است. از پارچههای نرم و قابل تنفس گرفته تا بطریهای سخت و بادوام، همه و همه حاصل تغییر در همان رابطه بنیادی ساختار-خواص هستند. در ادامه، به برخی از ملموسترین کاربردهای این مواد شگفتانگیز در صنعت و زندگی روزمره میپردازیم.
کاربردهای پلیاسترها در صنعت و زندگی
پلیاسترها به یکی از اجزای جدا نشدنی زندگی مدرن تبدیل شدهاند و کاربردهای آنها آنقدر گسترده است که شاید در یک روز عادی، دهها بار با محصولات ساخته شده از آنها سروکار داشته باشید. معروفترین کاربرد پلیاسترها در تولید الیاف و منسوجات است. پارچههای پلیاستری به دلیل استحکام بالا، مقاومت در برابر چروک و سریعخشک شدن، انقلابی در صنعت پوشاک و خانهداری ایجاد کردهاند.
در صنعت بستهبندی، پلیاسترهایی مانند PET (پلی اتیلن ترفتالات) نقش ابرقهرمان را بازی میکنند. از این ماده برای تولید بطریهای نوشیدنی، ظروف غذا و فیلمهای بستهبندی استفاده میشود. دلیل این محبوبیت، ویژگیهای ممتاز این پلیاستر است: شفافیت عالی، سبکی، غیرسمی بودن و مقاومت بالا در برابر ضربه. این ویژگیها باعث شده PET به یک ماده ایدهآل برای نگهداری ایمن مواد غذایی و نوشیدنیها تبدیل شود.
کاربردهای پلیاسترها به اینجا ختم نمیشود. از این ماده در تولید لاستیکهای مصنوعی، رزینهای پلیاستری برای ساخت بدنه قایق و خودرو، چسبهای قوی و حتی در پزشکی برای تولید نخهای بخیه قابل جذب و داربستهای بافتی استفاده میشود. این تنوع کاربرد، گواهی بر این موضوع است که چگونه درک یک واکنش شیمیایی پایه (استری شدن) میتواند به تولید موادی با کاربردهای تقریباً نامحدود بینجامد.
جمعبندی: از آزمایشگاه تا زندگی؛ سفر شگفتانگیز استرها
در این مقاله به طور کامل با واکنش استری شدن، این شاهکلید دنیای شیمی آلی، آشنا شدید. همانطور که دیدید، این واکنش ساده بین یک اسید و یک الکل، نه تنها منجر به تشکیل استرهای معطر میشود، بلکه سنگ بنای تولید پلیمرهای قدرتمندی مانند پلیاستر است. درک این مکانیسم به شما این توانایی را میدهد که دنیای اطراف خود را بهتر تحلیل کنید؛ از بوی آناناس در یک شوینده تا جنس پارچه ژاکت خود.
همانطور که آموختید، انتخاب مونومرهای مختلف و کنترل شرایط واکنش، میتواند منجر به تولید محصولاتی با خواص کاملاً متفاوت شود. این یعنی شیمی تنها یک علم تئوری نیست، بلکه یک ابزار قدرتمند برای طراحی و خلق مواد مورد نیاز بشر است. از تولید طعمدهندههای غذایی تا ساخت بطریهای پلاستیکی بادوام، همه و همه بر پایه اصولی است که امروز فرا گرفتید.
امیدواریم این مقاله از سایت تدریس شیمی متین هوشیار توانسته باشد این مبحث مهم از شیمی یازدهم را برای شما به شکلی ملموس و کاربردی روشن کند. به خاطر داشته باشید که این مباحث پایه، اولین قدم برای کشف دنیای بیکران شیمی و صنایع وابسته به آن هستند.

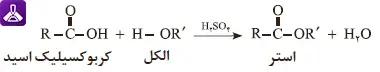




برای ارسال نظر لطفا ابتدا وارد حساب کاربری خود شوید. صفحه ورود و ثبت نام