رابطه سرعت واکنش با ضرایب استوکیومتری: چرا سرعت ها متفاوت هستند؟

شیمی، علمی پویا و مملو از تغییرات شگفتانگیز است که در آن، سرعت واکنشها نقش تعیینکنندهای در درک رفتار مواد دارد. این مفهوم اساسی در فصل دوم شیمی یازدهم به شکلی دقیق و کاربردی ارائه شده است. بسیاری از دانشآموزان هنگام مواجهه با مسائل این بخش، با چالشی روبرو میشوند: چگونه میتوان برای یک واکنش واحد، سرعتهای متفاوت مصرف واکنشدهندهها و تولید فرآوردهها را تفسیر کرد؟ آیا این سرعتهای به ظاهر متناقض، معنای یکسانی دارند؟
سایت تدریس شیمی متین هوشیار با تکیه بر سالها تجربه در آموزش شیمی، این مقاله را به صورت گامبهگام و با زبانی روشن تهیه کرده است. در ادامه، با بررسی رابطه بین سرعت واکنش و ضرایب استوکیومتری، نشان خواهیم داد که چگونه میتوان از چندین سرعت متفاوت، به یک مفهوم واحد و دقیق دست یافت. این مقاله نه تنها به سؤالات شما پاسخ میدهد، بلکه توانایی شما را در حل مسائل پیچیده این حوزه تقویت خواهد کرد.
سرعت واکنش چیست و چگونه تعریف میشود؟
سرعت واکنش، معیاری برای سنجش میزان پیشرفت یک تغییر شیمیایی در واحد زمان است. به بیان سادهتر، سرعت واکنش میگوید که با چه سرعتی مواد اولیه (واکنشدهندهها) مصرف میشوند و با چه سرعتی مواد جدید (فرآوردهها) تولید میشوند. این مفهوم، قلب تپندهی سینتیک شیمیایی است و به ما کمک میکند تا بتوانیم روند واکنشها را پیشبینی و کنترل کنیم.
درک این تعریف پایه، اولین گام برای حل همهی مسائل مربوط به این فصل است. برای اندازهگیری سرعت، نیاز به یک کمیت قابل اندازهگیری داریم که معمولاً غلظت مواد بر حسب مول بر لیتر (M) و تغییرات آن در طول زمان است.
تعریف سرعت برای مواد مختلف: مصرف شونده در مقابل تولید شونده
برای یک واکنشدهنده (ماده مصرفشونده)، سرعت به معنی کاهش غلظت در واحد زمان است. زیرا این ماده در حال استفاده شدن و کاهش یافتن است. برای یک فرآورده (ماده تولیدشونده)، سرعت به معنی افزایش غلظت در واحد زمان است. زیرا این ماده در حال ساخته شدن و افزایش یافتن است.
به عنوان مثال، در واکنش تجزیهی مالتوز:
C12H22O11 (aq) + H2O (l) → 2C6H12O6 (aq)
- سرعت مصرف مالتوز: میزان کاهش غلظت آن در ثانیه.
- سرعت تولید گلوکز: میزان افزایش غلظت آن در ثانیه.
نکتهی بسیار مهم اینجاست که این سرعتها به دلیل تفاوت در ضرایب استوکیومتری میتوانند عددی متفاوت داشته باشند، حتی اگر همه به یک واکنش واحد اشاره کنند.
واحد اندازه گیری سرعت واکنش در محاسبات
یکای استاندارد و رایج برای گزارش سرعت واکنش، مول بر لیتر بر ثانیه (mol/L·s) است. این واحد به ما میگوید که در هر ثانیه، غلظت یک ماده به اندازهی چند مول بر لیتر تغییر میکند.
برای نمایش غلظت مولی یک ماده در روابط، از کروشه [ ] استفاده میکنیم. برای مثال:
- [NH₃] به معنای «غلظت مولی آمونیاک» است.
- بنابراین، Δ[C₁₂H₂₂O₁₁]/Δt نشاندهندهی سرعت مصرف مالتوز است.
این قراردادها در تمام محاسبات مربوط به سرعت واکنش ثابت هستند و به یکپارچگی و درک بهتر مسائل کمک میکنند.
ضرایب استوکیومتری؛ کلید درک تفاوت سرعت ها
ضرایب استوکیومتری در یک معادله شیمیایی موازنه شده، تنها نسبت تعداد ذرات شرکت کننده در واکنش را نشان نمیدهند، بلکه نسبت میزان مصرف یا تولید آن مواد در واحد زمان را نیز تعیین میکنند. این ضرایب، دلیل اصلی تفاوت مقادیر عددی سرعت برای مواد مختلف در یک واکنش واحد هستند. در حقیقت، این ضرایب مانند یک قانون تناسب عمل میکنند که رابطه پنهان بین سرعتهای به ظاهر متفاوت را آشکار میسازند.
درک این ارتباط، مهمترین گام برای فراتر رفتن از حفظ فرمولها و رسیدن به یک درک مفهومی عمیق از سینتیک شیمیایی است. این رابطه به ما میآموزد که چرا نمیتوانیم تنها با نگاه کردن به یک عدد، سرعت کلی واکنش را گزارش دهیم و باید به دنبال یک معیار یکپارچه باشیم.
کشف رابطه: تحلیل شیب نمودارهای غلظت-زمان
شیب خط مماس بر منحنی در نمودارهای غلظت-زمان هر ماده، سرعت لحظهای آن را نشان میدهد. هنگامی که این نمودارها را برای مواد مختلف یک واکنش رسم میکنیم، یک الگوی بسیار جالب توجه ظاهر میشود: نسبت شیبها با نسبت ضرایب استوکیومتری آن مواد در معادله شیمیایی، رابطه عکس دارد.
- برای یک واکنشدهنده: شیب منفی است (غلظت کاهش مییابد).
- برای یک فرآورده: شیب مثبت است (غلظت افزایش مییابد).
مقدار عددی این شیبها متفاوت است، اما هنگامی که هر شیب را بر ضریب استوکیومتری ماده مربوطه تقسیم کنیم، به یک عدد ثابت و یکسان میرسیم. این عدد ثابت، در واقع سرعت پیشرفت خود واکنش است.
یک مثال ساده از دنیای واقعی: تولید آمونیاک
واکنش سنتز آمونیاک یک مثال کلاسیک و کاملاً گویا برای درک این مفهوم است:
N2 (g) + 3H2 (g) → 2NH3 (g)
معادله موازنه شده به ما میگوید:
- به ازای مصرف هر 1 مولکول N2، باید 3 مولکول H2 مصرف شود
- و در مقابل، 2 مولکول NH3 تولید شود
طبیعی است که سرعت مصرف H2 باید سه برابر سرعت مصرف N2 باشد، زیرا سه برابر سریعتر مصرف میشود. بهطور مشابه سرعت تولید NH3 باید دو برابر سرعت مصرف N2 باشد. این نسبتهای دقیقا برابر با ضرایب استوکیومتری هستند. بنابراین، اگر سرعت مصرف N2 را x بدانیم، آنگاه:
سرعت مصرف H2 = 3x
سرعت تولید NH3 = 2x
این مثال به وضوح نشان میدهد که چگونه ضرایب، بر سرعت نسبی مواد تأثیر میگذارند.
محاسبه سرعت واکنش؛ یک عدد واحد برای تمام مواد
با درک رابطه بین سرعت مواد مختلف و ضرایب استوکیومتری، اکنون میتوانیم به یک تعریف کمی و دقیق از سرعت واکنش دست پیدا کنیم. سرعت واکنش یک مقدار واحد و ثابت است که برای تمامی مواد شرکتکننده در یک واکنش شیمیایی یکسان است و معیار واقعی برای سنجش سرعت پیشرفت آن واکنش به شمار میرود. این مفهوم به ما کمک میکند تا از سردرگمی در مواجهه با اعداد مختلف رها شویم و یک معیار استاندارد برای گزارش و مقایسه سرعت واکنشها داشته باشیم.
برای به دست آوردن این عدد واحد، کافی است «سرعت متوسط مصرف یا تولید هر ماده را بر ضریب استوکیومتری آن در معادله موازنه شده تقسیم کنیم. نتیجه این تقسیم برای همه مواد یکسان خواهد بود» و همان سرعت واکنش است.
فرمول طلایی سرعت واکنش
فرمول اصلی و استاندارد برای محاسبه سرعت واکنش به صورت زیر تعریف میشود:
سرعت واکنش = – (1/a) (Δ[A]/Δt) = – (1/b) (Δ[B]/Δt) = + (1/c) (Δ[C]/Δt) = + (1/d) (Δ[D]/Δt)
در این رابطه:
- a و b ضرایب استوکیومتری واکنشدهندهها (A و B) هستند و علامت منفی نشاندهنده کاهش غلظت است.
- c و d ضرایب استوکیومتری فرآوردهها (C و D) هستند و علامت مثبت نشاندهنده افزایش غلظت است.
- Δ[] / Δt نشاندهنده تغییرات غلظت بر حسب زمان است.
این فرمول به ما میگوید که بدون توجه به اینکه کدام ماده را برای محاسبه انتخاب میکنیم، به یک عدد ثابت میرسیم.
حل گام به گام مسئله آمونیاک با فرمول جدید
برای درک بهتر، مسئله تولید آمونیاک را مرحله به مرحله حل میکنیم:
مسئله: سرعت متوسط تولید آمونیاک (Δ[NH3] / Δt) در یک بازه زمانی معین اندازهگیری شده است. سرعت مصرف N2 و H2 و همچنین سرعت واکنش را محاسبه کنید.
مراحل حل:
1. معادله موازنه شده:
N2 + 3H2 → 2NH3
2. محاسبه سرعت واکنش از طریق تولید آمونیاک:
سرعت واکنش = + (1/2) (Δ[NH3]/Δt) =
(1/2) × (4 × 10-3) = 2 × 10-3
3. محاسبه سرعت مصرف N2 با استفاده از سرعت واکنش:
سرعت واکنش = – (1/1) (Δ[N2]/Δt) =
-2 × 10-3 (علامت منفی نشاندهنده مصرف است)
4. محاسبه سرعت مصرف H2 با استفاده از سرعت واکنش:
سرعت واکنش = – (1/3) (Δ[H2]/Δt) =
-6 × 10-3
نتیجهگیری: سرعت واکنش برای این واکنش در شرایط استاندارد داده شده است. سرعت مصرف N2 یک سوم و سرعت مصرف H2 سه برابر سرعت تولید NH3 است که دقیقا با نسبت ضرایب استوکیومتری مطابقت دارد. این محاسبات تایید میکند که سرعت واکنش برای همه مواد یکسان است.
تحلیل یک واکنش واقعی: تبدیل مالتوز به گلوکز
بررسی دادههای تجربی یکی از بهترین روشها برای درک عمیق مفاهیم علمی است. در این بخش، واکنش هیدرولیز مالتوز (قند موجود در جوانه گندم) را که یک مثال واقعی و ملموس از فصل دوم شیمی یازدهم است، تحلیل میکنیم. این تحلیل به شما کمک میکند تا مفاهیم تئوری را در یک مثال عملی به کار بگیرید و توانایی خود را در تفسیر دادههای واقعی افزایش دهید.
واکنش هیدرولیز مالتوز به صورت زیر است:
C12H22O11 + H2O → 2C6H12O6
در این واکنش، مالتوز در حضور آب به دو مولکول گلوکز تبدیل میشود. با توجه به اینکه آب در مقایسه با مالتوز غلظت بسیار بالایی دارد، تغییرات غلظت آن ناچیز است و بنابراین سرعت واکنش تنها به غلظت مالتوز بستگی دارد.
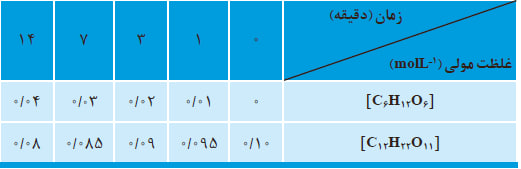
خواندن داده ها از جدول و نمودار
برای تحلیل این واکنش، به دادههای تجربی نیاز داریم. این دادهها بهطور کلی به صورت جدول یا نمودار ارائه میشوند. در اینجا نحوه استخراج اطلاعات از این منابع را مرور میکنیم:
الف) تفسیر جدول دادهها:
جدول دادهها معمولا شامل مقادیر غلظت مالتوز و گلوکز در زمانهای مختلف است. برای مثال:
- در زمان صفر، غلظت مالتوز حداکثر و غلظت گلوکز صفر است.
- با گذشت زمان، غلظت مالتوز کاهش و غلظت گلوکز افزایش مییابد.
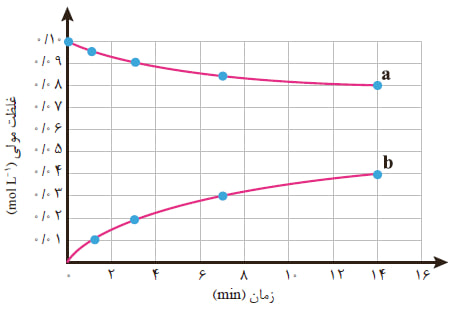
ب) تفسیر نمودار غلظت-زمان:
نمودار این واکنش غالبا شامل دو منحنی است:
- منحنی نزولی: مربوط به مالتوز (واکنشدهنده) که شیب منفی دارد.
- منحنی صعودی: مربوط به گلوکز (فرآورده) که شیب مثبت دارد.
شیب خط مماس بر هر منحنی در یک زمان خاص، سرعت لحظهای مصرف یا تولید آن ماده را نشان میدهد. برای محاسبه سرعت متوسط در یک بازه زمانی، میتوان از اختلاف غلظت در دو زمان مختلف استفاده کرد.
مقایسه سرعت واکنش در بازه های زمانی مختلف
سرعت یک واکنش شیمیایی معمولاً ثابت نیست و با گذشت زمان تغییر میکند. در مورد هیدرولیز مالتوز نیز این پدیده به وضوح مشاهده میشود:
محاسبه سرعت در بازههای مختلف:
- بازه اول (مثلاً 0 تا 7 دقیقه): در این بازه، غلظت مالتوز زیاد است و واکنش با سرعت نسبتاً بالایی پیش میرود.
- بازه دوم (مثلاً 7 تا 14 دقیقه): در این بازه، غلظت مالتوز کاهش یافته است و در نتیجه سرعت واکنش نیز کمتر میشود.
علت کاهش سرعت:
کاهش سرعت واکنش در بازه دوم به این دلیل است که با مصرف شدن تدریجی مالتوز، تعداد برخوردهای مؤثر بین مولکولها کاهش مییابد. این موضوع مطابق با اصول سینتیک شیمیایی است که سرعت واکنش را به غلظت واکنشدهندهها وابسته میداند.
نکته مهم:
سرعت واکنش در هر دو بازه زمانی را میتوان با استفاده از رابطه سرعت واکنش و دادههای جدول یا نمودار محاسبه کرد. این محاسبات به وضوح نشان میدهند که سرعت در بازه اول بیشتر از بازه دوم است.
جمعبندی نهایی: از سرعتهای مختلف به یک سرعت واحد
در این مقاله، به بررسی جامع مفهوم سرعت واکنش و رابطه آن با ضرایب استوکیومتری پرداختیم. همانطور که مشاهده کردید، در نگاه اول ممکن است به نظر برسد که برای یک واکنش شیمیایی واحد، چندین سرعت متفاوت وجود دارد. اما با درک صحیح رابطه بین این سرعتها و ضرایب استوکیومتری، به این نتیجه رسیدیم که در حقیقت، همه این سرعتها به یک مفهوم واحد اشاره دارند.
نکته کلیدی که باید همیشه به خاطر بسپارید این است که سرعت واکنش یک مقدار ثابت و یکتا است که برای تمام مواد شرکتکننده در واکنش یکسان است. این سرعت را میتوانیم از طریق رابطه زیر محاسبه کنیم:
سرعت واکنش = – (1/a) (Δ[A]/Δt) = – (1/b) (Δ[B]/Δt) = + (1/c) (Δ[C]/Δt) = + (1/d) (Δ[D]/Δt)
این رابطه به ما نشان میدهد که چگونه میتوان از سرعتهای به ظاهر متفاوت مواد مختلف، به یک مقدار واحد و معنادار دست یافت. درک این مفهوم نه تنها در حل مسائل تئوری، بلکه در تحلیل دادههای تجربی و تفسیر نمودارهای غلظت-زمان نیز به شما کمک خواهد کرد.
امیدواریم این مقاله از سایت تدریس شیمی متین هوشیار توانسته باشد به شما در درک عمیقتر این مبحث مهم از فصل دوم شیمی یازدهم کمک کند. به خاطر داشته باشید که تسلط بر این مفاهیم، پایه و اساس درک مباحث پیشرفتهتر در شیمی خواهد بود.




برای ارسال نظر لطفا ابتدا وارد حساب کاربری خود شوید. صفحه ورود و ثبت نام