شیمی یازدهم | فصل سوم: الکلها و اسیدها را قورت بده!

الکلها و اسیدهای کربوکسیلیک، دو خانوادهی مهم و پرکاربرد در شیمی آلی هستند که درک آنها کلید فهم بسیاری از پدیدههای روزمره است. این مقاله آموزشی از سایت تدریس شیمی متین هوشیار، به بررسی ساختار، ویژگیها و مثالهای عینی این ترکیبات میپردازد. قرار است این بخش از فصل سوم شیمی یازدهم را به زبانی ساده و گویا یاد بگیریم.
در این مطلب، شما به پاسخ پرسشهای اصلی خود خواهید رسید: الکل چیست و فرمول کلی آن چگونه است؟ چرا برخی اسیدها طعم ترش دارند و چگونه آنها را شناسایی کنیم؟ چه عواملی بر حلالیت الکلها در آب اثر میگذارد؟ با مطالعه این مقاله، بر مباحث پایهای این فصل مسلط خواهید شد.
ما در این نوشتار، با بررسی فرمولهای ساختاری و مدلهای مولکولی، این مفاهیم را به صورت تصویری و ملموس برای شما تشریح خواهیم کرد. هدف ما این است که با ارائهای شفاف و کاربردی، شما را برای امتحانات و کنکور آماده کنیم.
الکلها چه هستند و چه ساختاری دارند؟
الکلها دستهای از ترکیبهای آلی هستند که حضور آنها در زندگی روزمره و صنایع مختلف بسیار پررنگ است. نقطه اشتراک تمامی این ترکیبات، دارا بودن گروه عاملی هیدروکسیل (-OH) است که به یک اتم کربن با پیوند کووالانسی متصل شده است. این گروه عاملی، مسئول بسیاری از خواص فیزیکی و شیمیایی منحصر به فرد این خانواده است.
ساختار کلی مولکولهای الکل را میتوان به دو بخش مجزا تقسیمبندی کرد: یک بخش هیدروکربنی ناقطبی و یک گروه عاملی هیدروکسیل بسیار قطبی. این دوگانگی ساختاری، دلیل اصلی حلالیت خوب الکلهای با زنجیره کوتاه در آب و نیز نقطه جوش نسبتاً بالای آنها در مقایسه با ترکیبات آلی همکربن است.
شناسایی الکلها در شیمی آلی مبتنی بر تشخیص صحیح گروه عاملی آنها است. یک ترکیب تنها زمانی در رده الکلها قرار میگیرد که گروه هیدروکسیل مستقیماً به یک اتم کربن هیبرید sp³ متصل شده باشد. این تمایز برای جلوگیری از اشتباه گرفتن آنها با ترکیبات مشابه مانند فنولها ضروری است.
گروه عاملی هیدروکسیل؛ شناسنامه الکلها
گروه عاملی هیدروکسیل (OH-) مهمترین بخش در شناسایی و طبقهبندی الکلها است. این گروه از یک اتم اکسیژن و یک اتم هیدروژن تشکیل شده که با پیوند کووالانسی به یکدیگر متصل هستند. ویژگی کلیدی این گروه، اتصال مستقیم آن به یک اتم کربن هیبرید sp³ است که این موضوع الکلها را از سایر ترکیبات دارای گروه OH (مانند اسیدها یا فنولها) متمایز میکند.
وجود گروه هیدروکسیل، خواص فیزیکی و شیمیایی منحصر به فردی به مولکول میبخشد. این گروه به دلیل قطبیت بالا، توانایی ایجاد پیوند هیدروژنی قوی با مولکولهای آب و دیگر مولکولهای الکل را دارد. همین ویژگی، مسئول حلالیت بالای الکلهای کوتاهزنجیر در آب و نقطه جوش نسبتاً بالای آنها در مقایسه با آلکانهای همکربن است.
شناسایی صحیح گروه عاملی هیدروکسیل اولین قدم در تشخیص الکلها است. در نامگذاری آیوپاک، حضور این گروه با پسوند «ـ اول» نشان داده میشود. این گروه عاملی نه تنها در شناسایی، بلکه در پیشبینی رفتار شیمیایی و واکنشپذیری الکلها نیز نقش تعیینکنندهای دارد.
متانول و اتانول؛ معروفترین الکلهای یک عاملی
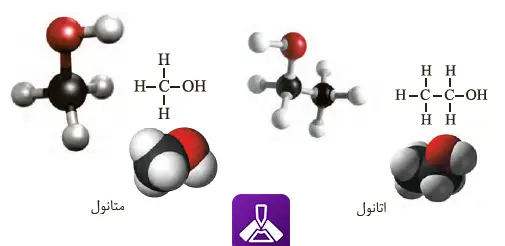
شکل 12 – فرمول ساختاری، مدل فضاپركن و گلوله_میله برای متانول و اتانول
متانول (CH₃OH) که با نام الکل متیلیک نیز شناخته میشود، سادهترین عضو خانواده الکلها است. این ترکیب مایعی بیرنگ، فرار و قابل اشتعال با بوی خاص است. متانول به عنوان حلال صنعتی، ضدیخ و ماده اولیه در تولید فرمالدئید و سایر ترکیبات شیمیایی کاربرد گستردهای دارد. البته باید توجه داشت که متانول سمی است و مصرف آن میتواند به کوری یا مرگ منجر شود.
اتانول (C₂H₅OH) یا الکل اتیلیک، شناختهشدهترین و پرکاربردترین الکل در صنایع مختلف است. این ترکیب مایعی بیرنگ با بوی خاص و نقطه جوش ۷۸ درجه سانتیگراد است. اتانول به عنوان ضدعفونیکننده در پزشکی، حلال در صنایع عطرسازی و داروسازی، و ماده اولیه در تولید نوشیدنیهای الکلی مورد استفاده قرار میگیرد. تولید صنعتی اتانول از طریق هیدراتاسیون اتیلن یا تخمیر قندها توسط مخمرها انجام میشود.
هر دو این الکلها به دلیل داشتن تنها یک گروه هیدروکسیل، در دسته الکلهای یک عاملی قرار میگیرند. شباهت ساختاری آنها در داشتن گروه OH است، اما تفاوت در طول زنجیر کربنی (متانول یک کربنه و اتانول دو کربنه) باعث تفاوت در خواص فیزیکی و شیمیایی آنها شده است.
فرمول کلی الکلها؛ از ROH سر درمیآوریم!
فرمول کلی ROH روشی استاندارد و علمی برای نمایش ساختار کلی الکلها است. در این نمادگذاری، R نشاندهنده یک گروه آلکیل است که میتواند متیل (CH₃-)، اتیل (C₂H₅-) یا هر گروه آلکیل دیگر باشد. گروه OH نیز نماینده گروه عاملی هیدروکسیل است که به گروه آلکیل متصل شده است.
این نمادگذاری به شیمیدانان امکان میدهد بدون نیاز به نوشتن ساختار کامل، به سادگی به طبقهبندی و مطالعه الکلها بپردازند. برای مثال، زمانی که R یک گروه متیل باشد، با متانول (CH₃OH) روبرو هستیم و وقتی R یک گروه اتیل باشد، ساختار اتانول (C₂H₅OH) را داریم.
درک این فرمول کلی برای دانشآموزان از این جهت حائز اهمیت است که پایه و اساس یادگیری نامگذاری آیوپاک، پیشبینی خواص فیزیکی و درک واکنشپذیری الکلها را فراهم میکند. این نماد ساده، درک پیچیدگیهای دنیای شیمی آلی را بسیار آسانتر میکند.
کربوکسیلیک اسیدها؛ ترش مزههای پرکاربرد
کربوکسیلیک اسیدها دستهای ضروری از ترکیبات آلی هستند که نقش بیبدیلی در جهان شیمی و زندگی روزمره ایفا میکنند. وجه تمایز این ترکیبات، دارا بودن گروه عاملی کربوکسیل (COOH-) است که به آنها ویژگی اسیدی میبخشد. این اسیدها مسئول طعم ترش بسیاری از میوهها و فرآوردههای غذایی هستند و در صنایع مختلف از داروسازی تا تولید پلیمرها کاربرد گستردهای دارند.
ساختار این اسیدها از دو بخش اصلی تشکیل شده است: یک گروه کربونیل (C=O) و یک گروه هیدروکسیل (OH-) که به همان اتم کربن متصل هستند. این آرایش خاص، باعث میشود هیدروژن موجود در گروه OH به راحتی آزاد شود و خاصیت اسیدی ایجاد کند. همین ویژگی، رفتار شیمیایی منحصر به فردی به این ترکیبات میبخشد.
شناسایی و درک کربوکسیلیک اسیدها نه تنها برای یادگیری شیمی آلی، بلکه برای درک بسیاری از فرآیندهای بیولوژیکی و صنعتی ضروری است. از تولید سرکه تا سنتز آسپرین، ردپای این ترکیبات را میتوان در اکثر فرآیندهای شیمیایی اطرافمان مشاهده کرد.
گروه کربوکسیل (COOH-)؛ قلب تپنده اسیدهای آلی
گروه کربوکسیل ترکیبی از دو گروه عاملی مهم است: گروه کربونیل (C=O) و گروه هیدروکسیل (OH). این دو گروه که بر روی یک اتم کربن قرار گرفتهاند، با همکاری یکدیگر خواص منحصر به فردی ایجاد میکنند. حضور همزمان این دو گروه عاملی، باعث ایجاد اثرات الکترونی خاصی میشود که نتیجه آن اسیدی بودن این ترکیبات است.
از نظر الکترونی، گروه کربونیل الکترونگاتیو بوده و میتواند بار منفی را به سوی خود جذب کند. این ویژگی باعث میشود پیوند O-H در گروه هیدروکسیل تضعیف شده و پروتون (H+) به راحتی آزاد شود. همین مکانیسم ساده، دلیل اصلی رفتار اسیدی این ترکیبات و توانایی آنها در آزادسازی پروتون است.
گروه کربوکسیل نه تنها در تعیین خواص اسیدی، بلکه در تعیین واکنشپذیری این ترکیبات نیز نقش کلیدی ایفا میکند. این گروه میتواند در واکنشهای مختلفی از جمله استریفیکاسیون، احیا و تشکیل نمک شرکت کند که هر یک کاربردهای صنعتی و آزمایشگاهی مهمی دارند.
متانوئیک اسید (جوهر مورچه)، یک اسید با تاریخچه جالب
متانوئیک اسید با فرمول شیمیایی HCOOH، سادهترین عضو خانواده کربوکسیلیک اسیدها است. این اسید که به نام جوهر مورچه نیز شناخته میشود، تاریخچه جالبی دارد. نام آن از کلمه لاتین «formica» به معنای مورچه گرفته شده است، زیرا اولین بار از تقطیر مورچههای قرمز به دست آمد.
این اسید مایعی بیرنگ با بوی تند و زننده است و خاصیت خورندگی دارد. متانوئیک اسید در طبیعت نه تنها در نیش حشراتی مانند مورچه و زنبور، بلکه در برخی گیاهان مانند گزنه نیز یافت میشود. این اسید هنگام گزش حشرات وارد پوست شده و باعث سوزش و خارش میشود.
از کاربردهای مهم متانوئیک اسید میتوان به استفاده به عنوان ماده نگهدارنده در صنایع غذایی، عامل ضدعفونیکننده در دامداریها و ماده اولیه در تولید برخی ترکیبات شیمیایی اشاره کرد. همچنین در صنعت نساجی برای تولید الیاف مصنوعی و در صنعت چرم برای دباغی مورد استفاده قرار میگیرد.
اتانوئیک اسید (استیک اسید)، اسید محبوب زندگی روزمره

شکل 13 – فرمول ساختاری استیك اسید و كاربردی از آن
اتانوئیک اسید با فرمول شیمیایی CH₃COOH، که بیشتر با نام استیک اسید شناخته میشود، یکی از پرکاربردترین اسیدهای آلی در زندگی روزمره است. این اسید ضعیف، مایعی بیرنگ با بوی تند و ترش است که مهمترین کاربرد آن در تولید سرکه میباشد. سرکه در واقع محلول آبی ۴ تا ۸ درصدی استیک اسید است.
استیک اسید کاربردهای صنعتی گستردهای نیز دارد. از آن به عنوان حلال در تولید بسیاری از ترکیبات آلی، ماده اولیه در تولید استات وینیل (برای ساخت پلیمرها) و در صنایع رنگ و رنگرزی استفاده میشود. همچنین در تولید داروها، مواد آرایشی و عطرها نقش مهمی ایفا میکند.
ویژگیهای فیزیکی و شیمیایی استیک اسید آن را به ترکیبی منحصر به فرد تبدیل کرده است. این اسید میتواند با الکلها واکنش داده و استر تولید کند، با بازها نمک تشکیل دهد و در بسیاری از واکنشهای شیمیایی آلی به عنوان کاتالیزور یا ماده اولیه عمل کند. نقطه ذوب ۱۶٫۶ درجه سانتیگرادی آن باعث میشود در دمای اتاق به صورت مایع باشد.
فرمول کلی اسیدها؛ شناخت فرمول RCOOH
فرمول کلی RCOOH روشی استاندارد برای نمایش تمامی کربوکسیلیک اسیدهای یک عاملی است. در این نمادگذاری، R نشاندهنده یک گروه آلکیل یا هیدروژن است و COOH نماینده گروه عاملی کربوکسیل میباشد. این نماد ساده به ما امکان میدهد بدون نیاز به نوشتن ساختار کامل، به مطالعه و طبقهبندی این ترکیبات بپردازیم.
هنگامی که R یک اتم هیدروژن باشد، با متانوئیک اسید (HCOOH) روبرو هستیم که سادهترین اسید این خانواده است. اگر R یک گروه متیل (CH₃-) باشد، ساختار اتانوئیک اسید (CH₃COOH) را داریم. با افزایش طول زنجیر کربنی R، به اسیدهای با وزن مولکولی بالاتر میرسیم که خواص فیزیکی و شیمیایی متفاوتی نشان میدهند.
درک این فرمول کلی پایه و اساس یادگیری نامگذاری آیوپاک برای کربوکسیلیک اسیدها است. این نمادگذاری به دانشآموزان کمک میکند تا به راحتی ساختارهای مختلف را تشخیص داده و واکنشپذیری آنها را پیشبینی کنند. همچنین، درک این فرمول برای مطالعه خواص فیزیکی مانند نقطه جوش و حلالیت این ترکیبات ضروری است.
با هم بیندیشیم صفحه 112 شیمی یازدهم
با توجه به دو ساختار داده شده به پرسش ها پاسخ دهید:
الف) پیش بینی كنید چه نوع نیروهای بین مولكولی در این دو الكل وجود دارد؟
جواب: نیروی جاذبه واندروالس و پیوند هیدروژنی
ب) مولكول این الكلها دو بخش قطبی و نا قطبی دارند. با توجه به اینكه گشتاور دوقطبی هیدروكربن ها حدود صفر است، این دو بخش را در هر مولكول بالا مشخص كنید.
جواب:
پ) پیش بینی كنید در شرایط یکسان انحلال پذیری كدام الكل در آب بیشتر است؟
جواب: انحلال پذیری اتانول در آب بیشتر است. هنگامی که بخش ناقطبی یک مولکول، بزرگتر از بخش قطبی آن باشد خواص ناقطبی مولکول بر خواص قطبی آن غلبه میکند. به همین جهت اوکتانول در آب حل نمی شود اما اتانول در آب با ایجاد پیوندهای هیدروژنی حل می شود.
ت) درستی پیش بینی خود را با توجه به داده های جدول زیر بررسی كنید.
جواب: همان طور که در جدول مشاهده میشود، اتانول به هر نسبتی در آب حل می شود؛ اما الکل هشت کربنه انحلال پذیری کمی در آب دارد.
ث) درباره درستی جمله زیر گفت وگو كنید.
«با افزایش طول زنجیر هیدروكربنی در الكل ها، نیروی واندروالس بر هیدروژنی غلبه می کند و ویژگی ناقطبی الكل افزایش مییابد.»
جواب: جمله درست است، زیرا در الکلها دو نوع نیروی بین مولکولی وجود دارد : پیوند هیدروژنی در یک سر مولکول که به دلیل پیوند بین اتم اکسیژن و هیدروژن وجود دارد و نیروی واندروالس که از سمت زنجیره کربنی وجود دارد. هرچه زنجیره کربنی بزرگتر باشد نیروی واندروالس قویتر شده و بر پیوند هیدروژنی غلبه میکند و ویژگی ناقطبی الکل زیاد میشود.
ج) نمودار زیر انحلال پذیری الكلها را در مقایسه با هیدروكربنها در آب نشان میدهد. روند تغییر آنها را توضیح دهید.
جواب: آلکانهای راست زنجیر چون مولکولهای ناقطبی هستند در آب حل نمیشوند اما در الکلها دو بخش قطبی و ناقطبی وجود دارد. در الکلهایی که تعداد کربن کمتری دارند، بخش قطبی به بخش ناقطبی غلبه میکند و در نتیجه الکل در آب حل میشود. اما با افزایش تعداد اتمهای کربن بخش ناقطبی به بخش قطبی غلبه کرده و در نتیجه انحلال پذیری الکل در آب کم میشود.
خود را بیازمایید صفحه 113 و 114 شیمی یازدهم
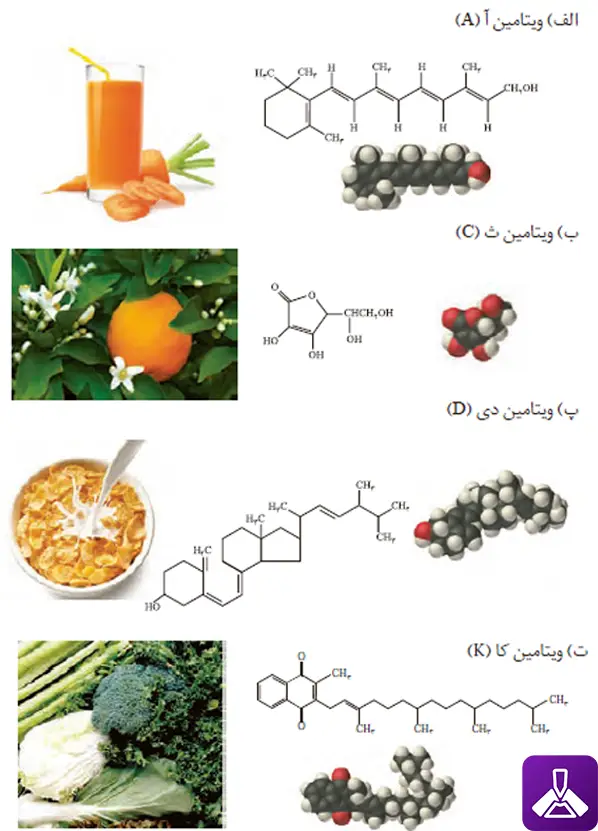
1. كدام ویتامینهای زیر در آب و كدامها در چربی حل میشود؟ چرا؟
جواب: ویتامینهای آ، کا و دی بخش ناقطبی بزرگ است و بر بخش قطبی غلبه میکند و در نتیجه این سه ویتامین در چربی حل میشوند.
در ویتامین ث به دلیل زیاد بودن تعداد بخشهای قطبی، بخش قطبی بر بخش ناقطبی غلبه میکند و در نتیجه این ویتامین در آب حل میشود.
2. مصرف بیش از اندازهی كدام دسته از ویتامینها برای بدن مشكل خاصی ایجاد نمیكند؟ چرا؟
جواب: ویتامینهایی که مثل ویتامین ث بخش قطبی بزرگی داشته باشند و در نتیجه در آب محلول باشند. زیرا مقدار اضافی این ویتامینها در بدن از طریق ادرار دفع میشوند.
3. گروه های عاملی موجود در هر یک از تركیب های بالا را مشخص كنید.
جواب:
4. عبارت زیر را با خط زدن واژهی نادرست در هر مورد كامل كنید.
جواب:
در ترکیبهای آلی مانند الکلها و کربوکسیلیک اسیدها که دو بخش قطبی و ناقطبی دارند، با افزایش طول زنجیر کربنی بخش (ناقطبی / قطبی) بزرگتر میشود، قطبیت مولکول (کاهش / افزایش) مییابد و انحلال پذیری آن در آب (بیشتر /کمتر) میشود.
جمعبندی نهایی الکلها و اسیدها
در این مقاله به بررسی دو خانواده مهم از ترکیبات آلی، یعنی الکلها و کربوکسیلیک اسیدها پرداختیم. این ترکیبات با دارا بودن گروههای عاملی ویژه، نقش تعیینکنندهای در شیمی آلی و زندگی روزمره ایفا میکنند. گروه هیدروکسیل (OH-) به عنوان شناسنامه الکلها و گروه کربوکسیل (COOH-) به عنوان قلب تپنده اسیدهای آلی، خواص منحصر به فردی به این ترکیبات بخشیدهاند.
الکلها با فرمول کلی ROH و کربوکسیلیک اسیدها با فرمول کلی RCOOH، هر کدام کاربردهای گستردهای در صنایع مختلف دارند. از متانول و اتانول به عنوان حلال و ضدعفونیکننده تا متانوئیک اسید و اتانوئیک اسید در تولید مواد غذایی و صنعتی، این ترکیبات به بخش جداییناپذیر زندگی مدرن تبدیل شدهاند. درک ساختار و خواص این مواد پایه و اساس یادگیری شیمی آلی را تشکیل میدهد.
مطالعه این ترکیبات نه تنها از جنبه علمی، بلکه از نظر کاربردی نیز حائز اهمیت است. توانایی پیشبینی رفتار شیمیایی، حلالیت و واکنشپذیری این ترکیبات، دانشآموزان را برای درک پیچیدگیهای جهان شیمی آلی آماده میکند. این دانش پایهای، زمینهساز کشف کاربردهای جدید و نوآوری در علوم مختلف خواهد بود.









برای ارسال نظر لطفا ابتدا وارد حساب کاربری خود شوید. صفحه ورود و ثبت نام