چقدر از هر گاز لازم است؟ آموزش کامل استوکیومتری واکنشهای گازی در شیمی دهم

- ضریب استوکیومتری در واکنشهای گازی چه نقشی دارد؟
- چه مقدار اکسیژن برای تولید گوگرد تریاکسید نیاز داریم؟
- مصرف گلوکز در بدن چقدر اکسیژن نیاز دارد؟
- در واکنش فسفر با کلر چه مقدار فرآورده و گاز داریم؟
- عوامل تبدیل در شیمی؛ راهی برای حرکت بین مول، گرم و لیتر
- یک مثال ترکیبی برای مرور کامل مفاهیم این بخش
- جمعبندی نکات مهم برای حل مسائل استوکیومتری گازی
در بسیاری از واکنشهای شیمیایی، یکی از مهمترین سؤالات این است: برای انجام کامل واکنش، از هر گاز چقدر نیاز داریم؟ یا اگر واکنش انجام شد، چند لیتر گاز تولید میشود؟ این سؤالها به ظاهر سادهاند، اما پاسخ دقیق به آنها، نیاز به شناخت ضریبهای معادله شیمیایی و رابطههای بین مول، لیتر و گرم دارد.
در این مقاله، که بخشی از فصل دو شیمی دهم است، مرحلهبهمرحله یاد میگیرید که چطور از روی معادله موازنهشده، مقدار گازها را محاسبه کنید. مثالهایی که بررسی میکنیم، هم از خود کتاب درسیاند، هم کاربردیاند: از سوختن گلوکز در بدن تا تولید فسفر تریکلرید در صنعت.
تمام آموزشها با هدف آمادگی برای امتحان و کنکور طراحی شدهاند و بر پایه منابع معتبر از جمله مطالب ارائهشده در سایت تدریس شیمی متین هوشیار نوشته شدهاند. اگر میخواهی دقیق بفهمی از هر گاز چقدر لازم است، این مقاله را تا انتها بخوان.
ضریب استوکیومتری در واکنشهای گازی چه نقشی دارد؟
برای اینکه بفهمیم در یک واکنش گازی از هر ماده چقدر لازم داریم، اولین قدم نگاهکردن به ضریبهای معادله شیمیایی موازنهشده است. این ضریبها نشان میدهند که نسبت مولی مواد شرکتکننده در واکنش چطور با هم مرتبطاند. اگر ضریب گاز اکسیژن ۳ باشد و ضریب گاز هیدروژن ۲، یعنی برای هر ۳ مول اکسیژن، باید ۲ مول هیدروژن استفاده شود.
در مسائل استوکیومتری گازها، ضریبها راهنمای اصلی ما هستند. آنها مشخص میکنند که نسبت بین گازها دقیقاً چند به چند است. این موضوع چه در محاسبه مولها و چه در تبدیل به حجم (لیتر) یا جرم (گرم)، اهمیت دارد. بدون توجه به ضریبها، محاسبات ما اشتباه خواهند بود.
در ادامه یاد میگیریم که چطور این نسبتها را تشخیص دهیم و از آنها برای حل دقیق مسائل استفاده کنیم.
نسبت بین مواد شرکتکننده در معادله شیمیایی
وقتی یک معادله شیمیایی را موازنه میکنیم، عددهایی که جلوی فرمولها میگذاریم را «ضریب» مینامند. این ضریبها فقط برای زیبایی نیستند؛ بلکه دقیقاً نشان میدهند که به ازای چند مول از یک ماده، چند مول از ماده دیگر مصرف یا تولید میشود.
مثلاً اگر در معادلهای بنویسیم:
O2 + 2H2 → 2H2O
یعنی دو مول گاز هیدروژن با یک مول گاز اکسیژن واکنش میدهند تا دو مول بخار آب بسازند. این نسبت ۲ به ۱ به ۲، همان چیزی است که از ضریبها میفهمیم.
در واکنشهای گازی، چون حجم گازها با مول آنها رابطه مستقیم دارد، همین نسبتها به ما کمک میکنند تا بدون تبدیل خاصی، مقدار گاز را حساب کنیم. فقط کافیست بدانیم کدام ماده چقدر دارد و بقیه را بر اساس ضریب محاسبه کنیم.
یک معادله ساده برای درک عمیق مفهوم ضریب
فرض کنید در یک واکنش ساده، گاز نیتروژن و هیدروژن با هم ترکیب میشوند تا آمونیاک تولید شود. معادله آن اینطور موازنه میشود:
N2 + 3H2 → 2NH3
از این معادله دقیقاً میفهمیم که برای تولید هر ۲ مول گاز آمونیاک، ۱ مول گاز نیتروژن و ۳ مول گاز هیدروژن نیاز داریم. اگر مثلاً ۶ مول گاز هیدروژن داشته باشیم، از روی ضریبها میتوانیم بفهمیم که به ۲ مول نیتروژن نیاز داریم و در نهایت ۴ مول آمونیاک به دست میآید.
همین مثالهای ساده کمک میکنند تا نقش ضریبها در محاسبه مقدار گاز کاملاً روشن شود. در ادامه مقاله، این مفاهیم را در واکنشهای واقعیتر مثل تنفس سلولی و تولید مواد صنعتی هم به کار میگیریم.
چه مقدار اکسیژن برای تولید گوگرد تریاکسید نیاز داریم؟
در واکنشهای گازی، دانستن نسبت بین مواد شرکتکننده بسیار مهم است. یکی از نمونههای واضح و مهم این موضوع، واکنش بین گوگرد دیاکسید (SO₂) و گاز اکسیژن (O₂) برای تولید گوگرد تریاکسید (SO₃) است.
این واکنش، هم در صنعت کاربرد دارد و هم نمونهای عالی برای آموزش محاسبه مقدار گازهاست. اگر بدانیم چند مول از یک ماده شرکت میکند، با استفاده از ضریبها میتوانیم مقدار گاز دیگر را دقیق حساب کنیم.
در ادامه، ابتدا معادله واکنش را موازنه میکنیم و سپس به کاربرد آن در صنعت تولید اسید سولفوریک میپردازیم.
واکنش بین گوگرد دیاکسید و اکسیژن را موازنه کنیم
معادله اصلی این واکنش به صورت زیر نوشته میشود:
SO2 + O2 → SO3
اما این معادله موازنه نیست. تعداد اتمهای گوگرد در دو طرف برابر است، ولی تعداد اتمهای اکسیژن نیست. با موازنه صحیح، خواهیم داشت:
2SO2 + O2 → 2SO3
اکنون تعداد اتمهای گوگرد و اکسیژن در دو طرف معادله برابر شده است. ضریبهای این واکنش به ما میگویند که برای تولید ۲ مول گوگرد تریاکسید، به ۲ مول گوگرد دیاکسید و ۱ مول گاز اکسیژن نیاز داریم.
اگر بخواهیم مقدار بیشتری از SO₃ تولید کنیم، فقط کافیست نسبتها را حفظ کنیم. مثلاً برای تولید ۸ مول SO₃، باید ۴ مول O₂ و ۸ مول SO₂ مصرف شود. این دقیقاً همان جاییست که ضریبها به کمک ما میآیند.
این واکنش چه کاربردی در صنعت دارد؟
این واکنش، فقط یک مثال آموزشی نیست. در صنعت، همین واکنش یکی از مراحل کلیدی تولید اسید سولفوریک (H₂SO₄) است. گوگرد تریاکسید (SO₃) مادهی واسطهای است که در فرآیند تهیه اسید سولفوریک نقش مهمی دارد.
تولید انبوه SO₃ در کارخانهها نیازمند محاسبه دقیق مقدار گازهاست. اگر مقدار اکسیژن درست تأمین نشود، واکنش ناقص خواهد بود و بازده پایین میآید. به همین دلیل، شناخت نسبتهای مولی در این واکنش برای مهندسان شیمی و متخصصان صنایع بسیار حیاتی است.
برای دانشآموزان هم این موضوع اهمیت دارد. چون میتوانند با درک این نسبتها، مسائل استوکیومتری را راحتتر حل کنند و نمره بالاتری در امتحان و کنکور بگیرند.
مصرف گلوکز در بدن چقدر اکسیژن نیاز دارد؟
بدن ما برای زندهماندن به انرژی نیاز دارد. این انرژی از راه تجزیه گلوکز (C₆H₁₂O₆) در واکنش با گاز اکسیژن (O₂) تأمین میشود. این فرایند در سلولها رخ میدهد و به آن تنفس سلولی میگویند.
در این واکنش، گلوکز با اکسیژن ترکیب میشود و گاز کربندیاکسید (CO₂) و بخار آب (H₂O) تولید میشوند. از آنجایی که گلوکز یک ترکیب شناختهشده است، میتوانیم معادلهی واکنش آن را بنویسیم و با استفاده از ضریبها، مقدار اکسیژن لازم برای مصرف گلوکز را محاسبه کنیم.
واکنش شیمیایی کامل اکسایش گلوکز
فرمول واکنش تنفس سلولی به شکل زیر نوشته میشود:
C₆H₁₂O₆ + 6O2 → 6O2 + 6H2O
این معادله موازنهشده است و ضریبها نشان میدهند که برای هر ۱ مول گلوکز، باید ۶ مول اکسیژن مصرف شود. همچنین، ۶ مول گاز کربندیاکسید و ۶ مول آب تولید میشوند.
نکته مهم این است که بین گلوکز و اکسیژن یک نسبت ۱ به ۶ برقرار است. یعنی اگر مقدار گلوکز مشخص باشد، خیلی راحت میتوان مقدار اکسیژن لازم را حساب کرد. همین نسبتها در محاسبه حجم و جرم گازها در مسائل امتحانی به کار میروند.
محاسبه مقدار اکسیژن برای مصرف ۲.۵ مول گلوکز
طبق معادله بالا، برای مصرف هر ۱ مول گلوکز به ۶ مول اکسیژن نیاز داریم. حالا اگر بدن در یک شبانهروز ۲.۵ مول گلوکز مصرف کند، باید:
2.5 × 6 = مول 15 O2
پس بدن به ۱۵ مول گاز اکسیژن نیاز دارد.
حالا اگر بخواهیم این مقدار را به لیتر گاز اکسیژن در شرایط STP تبدیل کنیم، باید از عدد ۲۲.۴ لیتر برای هر مول گاز استفاده کنیم:
15 × 22.4 = 336 لیتر O2
اگر بخواهیم بدانیم این مقدار اکسیژن چند گرم است، کافیست جرم مولی گاز اکسیژن را بدانیم. گاز O₂ جرم مولی ۳۲ گرم دارد:
15 × 32 = 480 گرم O2
نتیجه: برای مصرف ۲.۵ مول گلوکز، بدن به ۱۵ مول گاز اکسیژن نیاز دارد که برابر با ۳۳۶ لیتر در STP یا ۴۸۰ گرم اکسیژن است.
در واکنش فسفر با کلر چه مقدار فرآورده و گاز داریم؟
در شیمی، فقط ترکیبات آزمایشگاهی مطرح نیستند. بسیاری از واکنشها، پایه تولید مواد مهم صنعتیاند. یکی از این واکنشها، ترکیب فسفر (P₄) با گاز کلر (Cl₂) برای تولید فسفر تریکلرید (PCl₃) است.
این ترکیب در تولید حشرهکشها، پلاستیکها و مواد شیمیایی خاص کاربرد دارد. اما قبل از اینکه بخواهیم مقدار مواد مصرفی یا تولیدی را حساب کنیم، باید واکنش را درست بنویسیم و موازنه کنیم.
معادله واکنش فسفر و کلر را موازنه کنیم
فرمول واکنش اولیه به شکل زیر است:
P4 + Cl2 → PCl3
در سمت چپ، ۴ اتم فسفر داریم. سمت راست هم باید به همین تعداد برسیم. چون در هر مولکول PCl₃ یک فسفر هست، باید ۴ مولکول از آن تشکیل شود. همچنین، برای هر مول PCl₃، سه اتم کلر لازم است. بنابراین:
P4 + 6Cl2 → 4PCl3
این معادله اکنون موازنه است: ۴ فسفر و ۱۲ کلر در هر دو طرف. ضریبها به ما میگویند که ۱ مول P₄ با ۶ مول Cl₂ واکنش میدهد و ۴ مول PCl₃ تولید میشود.
با ۹۹۲ گرم فسفر، چند گرم PCl₃ تولید میشود؟
برای شروع، باید جرم مولی P₄ را حساب کنیم. چون فسفر عدد اتمی ۳۱ دارد، داریم:
جرم مولی P4 = 4 × 31 = 124 g/mol
حالا:
مول P4 = 992 ÷ 124 = 8 مول
بر اساس معادله:
P4 + 6Cl2 → 4PCl3
هر 1 مول «P4»، چهار مول PCl3 تولید میکند:
8 مول P4 ⇒ 32 مول PCl3
جرم مولی PCl₃ برابر است با:
MPCl3 = 31 + (35.5 × 3) = 137.5 g/mol
در نتیجه:
32 × 137.5 = 4400 گرم PCl3
یعنی از ۹۹۲ گرم فسفر، دقیقاً ۴۴۰۰ گرم فسفر تریکلرید به دست میآید.
برای واکنش کامل ۶۲۰ گرم فسفر، چه حجمی از گاز کلر نیاز داریم؟
اول، تعداد مولهای P₄ را پیدا میکنیم:
5 مول P4 = 620 ÷ 124
طبق معادله:
P4 + 6Cl2 → 4PCl3
هر ۱ مول P₄، به ۶ مول Cl₂ نیاز دارد:
5 مول P4 ⇒ 30 مول Cl2
حجم هر مول گاز در شرایط STP برابر با ۲۲.۴ لیتر است:
30 × 22.4 = 672 لیتر Cl2
بنابراین، برای واکنش کامل ۶۲۰ گرم فسفر، به ۶۷۲ لیتر گاز کلر در STP نیاز داریم.
عوامل تبدیل در شیمی؛ راهی برای حرکت بین مول، گرم و لیتر
در مسائل استوکیومتری، معمولاً اطلاعاتی به ما داده میشود و باید آن را به واحد دیگری تبدیل کنیم. گاهی تعداد مول را میدانیم و باید حجم گاز را پیدا کنیم. گاهی هم جرم ماده داده شده و باید بدانیم چند مول است.
اینجاست که مفهوم عامل تبدیل (conversion factor) به کمک ما میآید. این عاملها مثل پلهایی هستند که ما را از یک واحد به واحد دیگر میرسانند؛ مثلاً از مول به لیتر، یا از گرم به مول.
اگر عوامل تبدیل را خوب یاد بگیری، حل مسائل محاسباتی شیمی برایت بسیار راحتتر خواهد شد. در ادامه، سه نوع تبدیل مهم را بررسی میکنیم.
هر مول گاز در STP چه حجمی دارد؟
شرایط STP یعنی دما و فشار استاندارد (۰ درجه سانتیگراد و یک اتمسفر). در این شرایط، هر مول گاز خالص حجمی مشخص دارد:
یک مول گاز در شرایط STP = 22.4 liters
این عدد بسیار مهم است. با استفاده از آن، اگر بدانیم چند مول گاز داریم، بهراحتی میتوانیم حجم آن را در STP پیدا کنیم:
مثال:
اگر ۳ مول گاز داشته باشیم:
3 × 22.4 = 67.2 لیتر گاز
برعکس هم همینطور است: اگر حجم گاز را داشته باشیم، میتوانیم تعداد مول آن را با تقسیم بر ۲۲.۴ پیدا کنیم.
رابطه بین مول و گرم چگونه محاسبه میشود؟
برای تبدیل بین مول و گرم، باید جرم مولی ماده را بدانیم. جرم مولی یعنی جرم یک مول از یک ماده (بر حسب گرم) که از جدول تناوبی بهدست میآید.
فرمول کلی:
مثال: جرم مولی گاز اکسیژن (O₂) برابر با ۳۲ g/mol است. اگر ۶۴ گرم اکسیژن داشته باشیم:
2 مول O2 = 64 ÷ 32
و اگر بخواهیم برعکس عمل کنیم (یعنی از مول به گرم برسیم)، فقط کافیست مول را در جرم مولی ضرب کنیم.
حل یک مسئله ترکیبی با چند تبدیل پشتسرهم
فرض کنیم ۴۴.۸ لیتر گاز کربندیاکسید (CO₂) در STP داریم و میخواهیم بدانیم چند گرم CO₂ است.
مرحله اول: لیتر ← مول
2 مول CO2 = 44.8 ÷ 22.4
مرحله دوم: مول ← گرم
جرم مولی CO₂ برابر است با:
12 + (16 × 2) = 44 g/mol
بنابراین:
2 × 44 = 88 گرم CO2
یعنی ۴۴.۸ لیتر گاز CO₂ در STP معادل ۸۸ گرم است.
این نوع مسائل ترکیبی در امتحانهای مدرسه و تستهای کنکور بسیار رایجاند. اگر عوامل تبدیل را خوب بشناسی، حل آنها برایت ساده خواهد شد.
یک مثال ترکیبی برای مرور کامل مفاهیم این بخش
حالا که تمام مفاهیم استوکیومتری گازها، ضریبهای واکنش و تبدیل بین واحدها را یاد گرفتیم، وقت آن رسیده یک مثال جامع حل کنیم. این مثال کمک میکند تا ببینیم چطور همهچیز در کنار هم به کار میآید.
سؤال:
فرض کنید ۶۲۰ گرم فسفر (P₄) در اختیار داریم و میخواهیم بدانیم در واکنش با کلر:
- چه مقدار گاز کلر (Cl₂) نیاز است؟
- چند گرم فسفر تریکلرید (PCl₃) تولید میشود؟
- چه مقدار گاز کلر در شرایط STP مصرف میشود؟
مرحله ۱: نوشتن و موازنه واکنش
P4 + 6Cl2 → 4PCl3
مرحله ۲: محاسبه تعداد مول P₄
جرم مولی P₄ برابر ۱۲۴ گرم است:
مول P4 = 620 ÷ 124 = 5 مول
مرحله ۳: محاسبه مول گاز کلر (Cl₂)
طبق معادله، برای هر ۱ مول P₄، ۶ مول Cl₂ نیاز داریم:
5 × 6 = 30 مول Cl2
مرحله ۴: محاسبه حجم گاز کلر در STP
هر مول گاز در STP برابر با ۲۲.۴ لیتر است:
30 × 22.4 = 672 لیتر Cl2
مرحله ۵: محاسبه جرم PCl₃ تولیدشده
هر ۱ مول P₄، ۴ مول PCl₃ تولید میکند:
5 × 4 = 20 مول PCl3
جرم مولی PCl₃ برابر با:
31 + (3 × 35.5) = 137.5 گرم
در نتیجه:
20 × 137.5 = 2750 گرم PCl3
نتیجه نهایی:
- مقدار مورد نیاز گاز کلر: ۳۰ مول
- حجم گاز کلر در STP: ۶۷۲ لیتر
- جرم فسفر تریکلرید تولیدی: ۲۷۵۰ گرم
این مثال ترکیبی، نشان داد که اگر معادله را درست موازنه کنیم و از ضریبها بهدرستی استفاده کنیم، محاسبه دقیق گازها و فرآوردهها کاملاً قابل انجام است. این سبک سؤالها در امتحانات نهایی و تستهای کنکور بسیار پرکاربردند.
جمعبندی نکات مهم برای حل مسائل استوکیومتری گازی
برای حل مسائل استوکیومتری گازی در شیمی دهم، باید چند نکته کلیدی را خوب یاد بگیری:
۱. معادله شیمیایی را حتماً موازنه کن.
بدون موازنه، هیچ محاسبهای درست نخواهد بود. ضریبها پایهی همه نسبتها هستند.
۲. نسبت بین مولها را از روی ضریبها بخوان.
مثلاً اگر در واکنش، ضریب گاز A عدد ۲ و گاز B عدد ۳ باشد، نسبت آنها ۲ به ۳ است.
۳. از عوامل تبدیل استفاده کن.
برای تبدیل بین واحدهای مختلف مثل مول، لیتر و گرم، این عوامل ضروری هستند:
۱ مول گاز در شرایط STP برابر است با 22.4 لیتر
جرم مولی ماده = تبدیل بین مول و گرم
۴. مرحلهبهمرحله و منظم پیش برو.
در هر سؤال، ابتدا نوع واحد دادهشده را مشخص کن، سپس تبدیل را انجام بده و در آخر نتیجه را چک کن.
۵. به کاربردها دقت کن.
واکنشهای مربوط به گلوکز، گوگرد دیاکسید و فسفر فقط تمرین درسی نیستند؛ آنها در زندگی و صنعت کاربرد دارند.
اگر این مراحل را بهخوبی تمرین کرده باشی، حل مسائل استوکیومتری گازی برایت ساده و قابل مدیریت میشود چه در امتحان نهایی، چه در آزمونهای تستی.

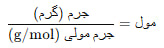



برای ارسال نظر لطفا ابتدا وارد حساب کاربری خود شوید. صفحه ورود و ثبت نام