سرعت متوسط واکنش (R̄): چگونه سرعت مصرف و تولید را اندازه بگیریم؟

سرعت واکنشهای شیمیایی، یکی از کلیدیترین مفاهیم در علم شیمی است که در صنایع مختلف از داروسازی تا تولید سوخت، اهمیت حیاتی دارد. اما مشاهدهٔ کیفی و توصیف واکنشها به صورت «سریع» یا «کند» برای اهداف علمی کافی نیست. آنچه به مقایسههای دقیق و پیشبینیهای معتبر منجر میشود، بیان کمّی و عددی سرعت است.
در این مقاله این بخش از مباحث فصل دوم شیمی یازدهم را پوشش میدهیم. قرار است گامبهگام بفهمیم چگونه میتوان سرعت مصرف مواد واکنشدهنده و سرعت تولید فرآوردهها را دقیقاً اندازهگیری و محاسبه کرد. در سایت تدریس شیمی متین هوشیار، شما با روشهای کاربردی محاسبه سرعت متوسط واکنش، تحلیل دادههای تجربی و حل مسائل متنوع این مبحث آشنا خواهید شد. هدف این است که پس از مطالعه این مقاله، توانایی محاسبه و تحلیل کمّی سرعت هر واکنش را به دست آورید.
سرعت واکنش؛ قلب تپندهٔ شیمی!
سرعت واکنشهای شیمیایی تنها به این اشاره ندارد که یک تغییر شیمیایی چقدر سریع به پایان میرسد. این مفهوم، در واقع میزان پیشرفت یک واکنش در واحد زمان را اندازهگیری میکند. همچنین به ما میگوید در هر ثانیه، دقیقه یا ساعت، چه مقدار از مواد اولیه مصرف شده و چه مقدار محصول جدید تولید میشود.
درک این نرخ تغییر، پایه و اساس پیشبینی رفتار سیستمهای شیمیایی، طراحی راکتورها و بهینهسازی فرآیندها در صنایع مختلف است. بدون quantifying یا کمیسازی سرعت، علم شیمی بیشتر به توصیفی کیفی و نادقیق محدود میشد.
چرا بیان کمی سرعت، زبان علم است؟
بیان کیفی سرعت، مانند گفتن «این واکنش خیلی سریع است»، subjective (ذهنی) است و معیار دقیقی ارائه نمیدهد. آنچه ممکن است برای یک نفر «سریع» باشد، برای دیگری «متوسط» تلقی میشود. علم بر پایه اعداد، اندازهگیریهای دقیق و قابلیت تکرار استوار است. وقتی سرعت یک واکنش را به صورت عددی و با یکای مشخص (مانند mol/s) بیان میکنیم، چندین مزیت کلیدی به دست میآوریم:
- قابلیت مقایسه: میتوانیم سرعت واکنشهای مختلف را در شرایط یکسان به دقت با هم مقایسه کنیم.
- قابلیت پیشبینی: میتوانیم محاسبه کنیم در یک بازه زمانی مشخص چه مقدار ماده مصرف یا تولید میشود.
- قابلیت اعتبار و صحت: دادههای کمی توسط دیگر دانشمندان قابل ارزیابی و تأیید هستند. این دقیقاً همان چیزی است که به یافتههای علمی اعتبار میبخشد.
نگاهی به تغییرات: از مصرف واکنشدهنده تا تولید فرآورده
در هر واکنش شیمیایی، دو روند همزمان و وابسته به هم رخ میدهد:
- مصرف تدریجی واکنشدهندهها: مقدار مواد اولیه به مرور زمان کاهش مییابد تا در نهایت به صفر برسد یا به حالت تعادل برسد.
- تولید تدریجی فرآوردهها: همزمان با مصرف شدن واکنشدهندهها، محصولات جدید شروع به تشکیل و تجمع میکنند.
سرعت واکنش در واقع معیاری برای سنجش همین تغییرات همزمان است. ما میتوانیم سرعت را هم از روی نرخ کاهش مقدار واکنشدهنده و هم از روی نرخ افزایش مقدار فرآورده محاسبه کنیم. این دو نرخ از نظر عددی به هم مرتبط هستند. با استفاده از ضرایب استوکیومتری معادله واکنش میتوان آنها را به یکدیگر تبدیل کرد. برای مثال، در واکنش تجزیه:
aA → bB
رابطه بین سرعت مصرف A و سرعت تولید B به این شکل است:
این نشان میدهد که چگونه نرخ تغییرات همه گونههای درگیر در واکنش به یکدیگر وابسته هستند.
تعریف سرعت متوسط واکنش (R̄) و فرمول آن
سرعت واکنش در طول زمان ثابت نیست و معمولاً با مصرف شدن واکنشدهندهها کاهش مییابد. بنابراین، معمولاً از سرعت متوسط واکنش صحبت میکنیم که میانگین نرخ پیشرفت واکنش در یک بازه زمانی مشخص است. این مفهوم کلیدی، پایه کمیسازی تمام تحلیلهای سینتیکی است. سرعت متوسط را با نماد R̄ نشان میدهند که یک خط بالای حرف R قرار میگیرد. این کمیت مقداری مثبت است و برای هر ماده شرکتکننده در واکنش میتوان آن را تعریف کرد.
مفهوم Δn و Δt: سنگبناهای محاسبه سرعت
سرعت متوسط بر اساس دو تغییر پایهای محاسبه میشود:
- Δn (دلتا n): تغییر در تعداد مولهای یک ماده خاص. این تغییر میتواند کاهشی (برای واکنشدهندهها) یا افزایشی (برای فرآوردهها) باشد.
- Δt (دلتا t): تغییر در زمان، یعنی طول بازه زمانی که این تغییر تعداد مول در آن رخ داده است.
فرمول کلی سرعت متوسط برای ماده A به صورت زیر است:
R̄(A) = |ΔnA| ÷ Δt
نکات کلیدی فرمول:
- از علامت قدر مطلق (| |) استفاده میشود تا سرعت متوسط همیشه مقداری مثبت باشد.
- یکای سرعت متوسط بر حسب mol/s (مول بر ثانیه) یا mol/min (مول بر دقیقه) است.
- برای واکنشدهندهها، Δn منفی است، اما با گذاشتن قدر مطلق، سرعت مثبت گزارش میشود.
- برای فرآوردهها، Δn مثبت است.
حل یک مثال ساده: محاسبه سرعت مصرف در واکنش رنگبری
فرض کنید در واکنش بین یک رنگ غذا و سفیدکننده، در زمان صفر، ۰.۰۵ مول رنگ موجود است. پس از ۲.۵ دقیقه، مقدار رنگ به ۰.۰۲۵ مول میرسد. مطلوب است محاسبه سرعت متوسط مصرف رنگ در این بازه زمانی.
مراحل حل:
۱. تعیین Δn (تغییر تعداد مول رنگ):
Δnرنگ = nنهایی – nاولیه
= 0.025 – 0.050 = -0.025 mol
۲. تعیین Δt (تغییر زمان):
Δt = tنهایی – tاولیه
= 2.5 – 0 = 2.5 min
۳. اعمال فرمول سرعت متوسط (با استفاده از قدر مطلق Δn):
نتیجه نهایی: سرعت متوسط مصرف رنگ در ۲.۵ دقیقه اول واکنش، ۰.۰۱ مول بر دقیقه است. این عدد به ما میگوید که به طور میانگین، در هر دقیقه از این بازه زمانی، ۰.۰۱ مول از رنگ غذا مصرف شده است.
اندازهگیری سرعت با تغییر کمیتهای قابل مشاهده
برای محاسبه سرعت متوسط یک واکنش، باید تغییر در مقدار یک ماده (Δn) را در یک بازه زمانی (Δt) اندازه بگیریم. از آنجایی که نمیتوان مستقیماً تعداد مولها را شمارش کرد، از تغییر در کمیتهای فیزیکی قابل اندازهگیری که با تغییر تعداد مولها رابطه مستقیم دارند، استفاده میکنیم. انتخاب هوشمندانه این کمیت، کلید موفقیت در تعیین سرعت است.
روش کلی: دنبال کردن تغییر غلظت مواد
متداولترین و مستقیمترین روش برای ردیابی سرعت یک واکنش، اندازهگیری تغییرات غلظت یکی از مواد شرکتکننده در طول زمان است. از آنجایی که غلظت با تعداد مولها رابطه مستقیم دارد (C = n/V)، با اندازهگیری آن میتوان Δn را استخراج کرد.
چگونه انجام میشود؟
- در بازههای زمانی منظم، نمونههای کوچکی از مخلوط واکنش برداشته میشود.
- واکنش در آن نمونه بلافاصله متوقف میشود (مثلاً با سرد کردن سریع یا رقیق کردن شدید).
- سپس غلظت ماده مورد نظر در آن نمونه با روشهای مختلف مانند تیتراسیون یا طیفسنجی اندازهگیری میشود.
مثال: در واکنش رنگبری که پیشتر بررسی کردیم، با اندازهگیری شدت رنگ محلول (که مستقیماً به غلظت رنگ مرتبط است) در زمانهای مختلف، میتوان به دادههای غلظت-زمان دست یافت و سرعت را محاسبه کرد.
یک روش هوشمندانه: اندازهگیری کاهش جرم در واکنشهای تولید گاز
هنگامی که یکی از محصولات واکنش، گاز باشد، میتوان از یک روش غیرمستقیم و بسیار هوشمندانه استفاده کرد: اندازهگیری کاهش جرم کل سیستم.
اصل کار: اگر واکنش در یک ظرف باز انجام شود، گاز تولیدشده از سیستم خارج میشود. بر اساس قانون پایستگی جرم، جرم از دست رفته سیستم، دقیقاً برابر با جرم گاز تولیدشده است.
چگونه انجام میشود؟
1. ظرف حاوی واکنشدهندهها را روی یک ترازوی دیجیتال با دقت بالا قرار میدهیم.
2. واکنش را آغاز میکنیم.
3. ترازو به طور پیوسته یا در بازههای زمانی مشخص، جرم باقیمانده را ثبت میکند.
4. جرم گاز تولیدشده در هر بازه زمانی از رابطه زیر به دست میآید:
mگاز = mاولیه – mt در زمان
5. سپس با استفاده از جرم مولی گاز، جرم به دست آمده را به تعداد مول (Δn) تبدیل کرده و سرعت متوسط تولید گاز را محاسبه میکنیم.
نکته کلیدی: این روش فقط برای واکنشهایی قابل استفاده است که حداقل یکی از محصولات، گازی فرار باشد که از سیستم خارج شود. واکنش کلسیم کربنات با اسید که تولید کربن دیاکسید میکند، نمونه کلاسیك این روش است.
حل گامبهگام یک آزمایش: واکنش کلسیم کربنات با اسید
واکنش کلسیم کربنات (سنگ آهک) با اسید کلریدریک، یک آزمایش کلاسیک برای مطالعه کمی سرعت واکنش است. این واکنش که تولید گاز کربن دیاکسید میکند، نمونهای ایدهآل برای به کارگیری روش اندازهگیری کاهش جرم است. معادله این واکنش به صورت زیر است:
CaCO3 (s) + 2HCl (aq) → CaCl2 (aq) + CO2 (g) + H2O (l)
در این آزمایش، ظرف واکنش روی یک ترازوی دیجیتال قرار میگیرد و کاهش جرم بر اثر خروج گاز CO₂ در بازههای زمانی ۱۰ ثانیه ثبت میشود. دادههای به دست آمده در جدول زیر خلاصه شده است:
| زمان (ثانیه) | ۰ | ۱۰ | ۲۰ | ۳۰ | ۴۰ | ۵۰ | ۶۰ |
|---|---|---|---|---|---|---|---|
| جرم مخلوط (g) | ۶۵.۹۸ | ۶۵.۳۲ | ۶۴.۸۸ | ۶۴.۶۶ | ۶۴.۵۵ | ۶۴.۵۰ | ۶۴.۵۰ |
| جرم CO₂ تولیدشده (g) | ۰.۰۰ | ۰.۶۶ | ۱.۱۰ | ۱.۳۲ | ۱.۴۳ | ۱.۴۸ | ۱.۴۸ |
(جرم CO₂ از رابطه: جرم اولیه – جرم در زمان t، محاسبه شده است)
تحلیل دادههای جدول: از عدد تا مفهوم
با نگاهی به دادههای جدول، چندین مفهوم مهم به چشم میخورد:
- کاهش جرم: جرم مخلوط واکنش به طور پیوسته از ۶۵.۹۸ گرم به ۶۴.۵۰ گرم کاهش یافته است. این کاهش جرم ناشی از خروج گاز CO₂ از سیستم است.
- پایان واکنش: از زمان ۵۰ ثانیه به بعد، جرم سیستم ثابت میماند (۶۴.۵۰ گرم). این ثبات نشان میدهد که واکنش کامل شده و هیچ گاز دیگری تولید نمیشود. در این مورد، یکی از واکنشدهندهها (احتمالاً کلسیم کربنات) به طور کامل مصرف شده است.
- نمودار تغییرات: اگر جرم CO₂ تولیدشده بر حسب زمان رسم شود، یک منحنی به دست میآید که شیب آن در ابتدا زیاد است و به تدریج کم میشود تا به یک خط افقی (شیب صفر) برسد. این تغییر شیب، خود نشاندهنده کاهش تدریجی سرعت واکنش است.
محاسبه سرعت تولید CO₂ در بازههای زمانی مختلف
سرعت متوسط تولید CO₂ در بازههای مختلف را محاسبه میکنیم. یکای سرعت، mol/s خواهد بود. (جرم مولی CO₂ = 44 g/mol)
بازه ۰ تا ۱۰ ثانیه:
Δجرم CO₂ = 0.66 – 0.00 = 0.66 g
Δn CO₂ = 0.66 / 44 = 0.015 mol
Δt = 10 – 0 = 10 s
= |0.015| ÷ 10 = 0.0015 mol/s
بازه ۳۰ تا ۴۰ ثانیه:
Δجرم CO₂ = 1.43 – 1.32 = 0.11 g
Δn CO₂ = 0.11 / 44 = 0.0025 mol
Δt = 40 – 30 = 10 s
= |0.0025| ÷ 10 = 0.00025 mol/s
مقایسه: مشاهده میشود که سرعت متوسط تولید CO₂ در ۱۰ ثانیه اول (0.0015 mol/s) بسیار بیشتر از سرعت متوسط در بازه ۳۰ تا ۴۰ ثانیه (0.00025 mol/s) است.
چرا از سرعت واکنش با گذشت زمان کاسته میشود؟
کاهش سرعت واکنش در این آزمایش و اغلب واکنشها را میتوان با مدل برخورد توضیح داد:
- کاهش غلظت واکنشدهندهها: در ابتدا، غلظت اسید و سطح تماس کلسیم کربنات در بیشترین مقدار خود است. در نتیجه، تعداد برخوردهای مؤثر بین ذرات در واحد زمان زیاد است و واکنش سریع پیش میرود. به تدریج و با مصرف شدن واکنشدهندهها، غلظت آنها کاهش مییابد. کاهش غلظت به معنای کاهش تعداد برخوردهای مؤثر در واحد زمان است و در نتیجه سرعت واکنش کم میشود.
- کاهش سطح تماس (برای واکنشدهنده جامد): در مورد کلسیم کربنات که جامد است، با پیشرفت واکنش، از اندازه ذرات جامد کاسته میشود و سطح تماس آن با اسید کاهش مییابد. این کاهش سطح تماس نیز مستقیماً به کاهش سرعت واکنش منجر میشود.
این تحلیل دادهها به وضوح نشان میدهد که سرعت یک واکنش شیمیایی مقدار ثابتی نیست و به شرایط لحظهای سیستم بستگی دارد.
بررسی یک واکنش جانشینی: روی در محلول مس (II) سولفات
یکی دیگر از آزمایشهای کلیدی برای درک سرعت واکنش، مشاهده واکنش جانشینی یک فلز با نمک فلز دیگر است. وقتی یک تیغه روی (Zn) را درون محلول آبی مس(II) سولفات (CuSO₄) قرار میدهیم، یک واکنش جابجایی یگانه رخ میدهد که تغییرات آن به خوبی قابل مشاهده و اندازهگیری است. معادله این واکنش به صورت زیر است:
Zn (s) + CuSO4 (aq) → ZnSO4 (aq) + Cu (s)
یا به شکل یونی:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
در طول این واکنش، رنگ آبی روشن محلول (ناشی از یونهای Cu²⁺) به تدریج محو میشود و یک لایه قهوهای-قرمز از فلز مس بر روی تیغه روی رسوب میکند.
پیشبینی نتیجه واکنش: مقایسه واکنشپذیری روی و مس
برای پیشبینی اینکه آیا این واکنش رخ میدهد یا خیر، باید به سری الکتروشیمیایی فلزات مراجعه کنیم. در این سری، فلزاتی که تمایل بیشتری به از دست دادن الکترون و اکسید شدن دارند، در جایگاه بالاتری قرار گرفته و واکنشپذیرتر محسوب میشوند.
- روی (Zn) در سری الکتروشیمیایی بالاتر از مس (Cu) قرار دارد.
- این یعنی فلز روی واکنشپذیرتر است و تمایل بیشتری برای اکسید شدن و تبدیل به یون Zn²⁺ دارد.
- در نتیجه، روی میتواند یون Cu²⁺ را از محلول خارج کند و آن را به فلز مس (Cu) کاهش دهد و خودش به جای آن در محلول قرار گیرد.
نتیجه پیشبینی: واکنش به سمت راست پیشرفت میکند. روی مصرف میشود، یونهای مس از محلول حذف میشوند، یونهای روی در محلول ظاهر میشوند و فلز مس به عنوان یک فرآورده جامد تولید میگردد.
تحلیل کمی: محاسبه سرعت مصرف یونهای مس (Cu²⁺)
فرض کنید در یک آزمایش، ۰.۰۳ مول CuSO₄ در محلول وجود دارد. با قرار دادن یک تیغه روی در محلول و اندازهگیری غلظت یونهای مس در زمانهای مختلف، دادههای زیر به دست آمده است:
| زمان (دقیقه) | ۰ | ۱ | ۲ | ۳ | ۴ | ۵ |
|---|---|---|---|---|---|---|
| تعداد مول Cu²⁺ | ۰.۰۳۰ | ۰.۰۲۴ | ۰.۰۱۹ | ۰.۰۱۵ | ۰.۰۱۲ | ۰.۰۱۰ |
مطلوب است محاسبه سرعت متوسط مصرف یون مس در دو دقیقه اول واکنش.
مراحل محاسبه:
تعیین Δn (تغییر تعداد مول یون Cu²⁺) بین t=0 و t=2 min:
ΔnCu2+ = nنهایی – nاولیه =
0.019 – 0.030 = -0.011 mol (علامت منفی نشاندهنده کاهش و مصرف شدن است)
تعیین Δt (تغییر زمان):
Δt = tنهایی – tاولیه =
2 – 0 = 2 min
اعمال فرمول سرعت متوسط مصرف (با استفاده از قدر مطلق Δn):
نتیجه نهایی: سرعت متوسط مصرف یونهای مس در دو دقیقه اول این واکنش، ۰.۰۰۵۵ مول بر دقیقه است. این عدد کمی به ما میگوید که واکنش با چه سرعتی پیش میرود. برای درک کاملتر، میتوان این محاسبه را در بازههای زمانی مختلف تکرار کرد تا الگوی کاهش سرعت در طول زمان نیز مشاهده شود.
جمع بندی: از مشاهده تا عدد
در این مقاله، سفر کاملِ تبدیل یک مشاهده کیفی به یک تحلیل کمی را گام به گام طی کردیم. آنچه با چشم میبینیم —محو شدن تدریجی یک رنگ، خروج حبابهای گاز از یک مخلوط واکنش، یا تشکیل یک رسوب فلزی بر روی یک فلز دیگر— همگی جلوههای ظاهری و کیفی از نرخهای متفاوت واکنشهای شیمیایی هستند. اما زبان واقعی علم، زبان اعداد و دادههای کمی است.
مفاهیم کلیدی که در این مسیر آموختیم را میتوان در چند اصل خلاصه کرد:
- سرعت متوسط (R̄)، مفهوم محوری برای کمیسازی نرخ یک واکنش است. این کمیت، میانگین تغییر در تعداد مولهای یک ماده در واحد زمان را بیان میکند و همواره مقداری مثبت است.
- برای محاسبه سرعت، باید تغییر در مقدار یک ماده (Δn) را اندازه بگیریم. از آنجایی که شمارش مستقیم مولها ممکن نیست، با اندازهگیری تغییر در یک کمیت فیزیکی مرتبط مانند کاهش جرم (در واکنشهای تولید گاز) یا تغییر غلظت (با روشهایی مانند طیفسنجی)، این تغییر را استنباط میکنیم.
- سرعت یک واکنش، مقداری ثابت و ایستا نیست. دادههای تجربی به وضوح نشان میدهند که سرعت با پیشرفت واکنش و کاهش غلظت واکنشدهندهها (و در مورد مواد جامد، کاهش سطح تماس) کاهش مییابد.
- توانایی پیشبینی نتیجه یک واکنش (مانند مقایسه واکنشپذیری فلزات بر اساس سری الکتروشیمیایی) و سپس تأیید آن پیشبینی با اندازهگیری کمی سرعت، نقطه اوج توانمندی یک شیمیدان است.
در نهایت، تسلط بر این مفاهیم و مهارتهای محاسباتی، پایه و اساس درک فصلهای پیشرفتهتر سینتیک و همچنین درک دنیای واقعی، از بهینهسازی فرآیندهای صنعتی گرفته تا پیشبینی سرعت مصرف دارو در بدن، خواهد بود. شما اکنون این توانایی را دارید که به پدیدههای شیمیایی نه به عنوان رویدادهایی کیفی، بلکه به عنوان فرآیندهایی کمیشدنی نگاه کنید.


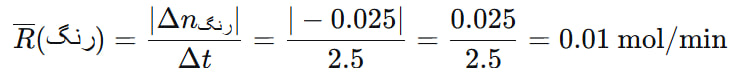



برای ارسال نظر لطفا ابتدا وارد حساب کاربری خود شوید. صفحه ورود و ثبت نام