رسانایی الكتریكی محلول ها و قدرت اسیدی؛ از غلظت هیدرونیوم تا درجه یونش

- غلظت یون هیدرونیوم و اثر آن بر پایداری مواد
- دو نوع رسانایی در شیمی؛ الکترونی و یونی
- چطور محلولها را به الکترولیت و غیرالکترولیت دستهبندی میکنیم؟
- رسانایی محلولهای اسیدی و ارتباط آن با قدرت اسید
- یونش اسیدها در آب و معادلههای واکنش
- درجه یونش و درصد یونش؛ تعریف، فرمول و مثال
- دستهبندی اسیدها بر اساس میزان یونش
- کاربرد مفاهیم رسانایی و یونش در حل مسائل شیمی دوازدهم
دانستن اینکه چرا بعضی محلولها جریان برق را بهخوبی عبور میدهند و بعضی دیگر این توانایی را ندارند، یکی از کلیدهای فهم واکنشهای شیمیایی است. این مقاله بخشی از فصل اول شیمی دوازدهم است و به شما کمک میکند مفهوم رسانایی الکتریکی محلولها را ساده و دقیق درک کنید.
در ادامه خواهید دید که رسانایی چه ارتباطی با قدرت اسیدی دارد و چگونه غلظت یون هیدرونیوم میتواند بر ماندگاری مواد خوراکی، دارویی و بهداشتی اثر بگذارد. مثالهایی مانند ترش شدن شیر یا تغییر کیفیت دارو، نشان میدهند این موضوع فقط یک مفهوم تئوری در کتاب نیست، بلکه در زندگی روزمره کاربرد دارد.
همچنین با خواندن این مطلب متوجه میشوید چرا اسید قوی مثل هیدروکلریک اسید رسانایی بیشتری از یک اسید ضعیف دارد و چگونه محاسبه درجه یونش میتواند قدرت اسیدی را مشخص کند. این محتوای آموزشی در سایت تدریس شیمی متین هوشیار تهیه شده تا قبل از ورود به کلاس، بخش مهمی از مبحث را یاد بگیرید و با آمادگی بیشتری ادامه درس را دنبال کنید.
غلظت یون هیدرونیوم و اثر آن بر پایداری مواد
غلظت یون هیدرونیوم در یک محلول، شاخص مهمی برای تعیین میزان اسیدی بودن آن است. این غلظت نهتنها در آزمایشگاه، بلکه در زندگی روزمره نیز اثرات آشکاری دارد. برای مثال، وقتی غلظت یون هیدرونیوم در شیر افزایش پیدا کند، شیر ترش شده و دیگر قابل مصرف نیست.
تغییر غلظت یون هیدرونیوم میتواند سرعت واکنشهای شیمیایی را در مواد خوراکی، دارویی و بهداشتی تغییر دهد. افزایش این غلظت معمولاً باعث کاهش ماندگاری محصول میشود، زیرا شرایط اسیدیتر، امکان رشد برخی میکروارگانیسمها یا تخریب ترکیبات حساس را فراهم میکند.
در مقابل، کاهش غلظت یون هیدرونیوم و نزدیک شدن pH به حالت خنثی، به پایداری بیشتر بسیاری از محصولات کمک میکند. به همین دلیل، کنترل اسیدیته در صنایع غذایی، تولید دارو و محصولات آرایشی اهمیت زیادی دارد. درک این موضوع برای دانشآموزان، پایهای قوی برای یادگیری بخشهای بعدی مبحث قدرت اسیدی فراهم میکند.
مثال عددی
فرض کنید pH شیر تازه حدود 6.5 است. اگر بهدلیل فعالیت باکتریها، pH به 5.0 کاهش یابد، یعنی غلظت یون هیدرونیوم تقریباً 30 برابر شده است. این تغییر، طعم شیر را ترش میکند و باعث انعقاد پروتئینها میشود.
جدول تغییر غلظت یون هیدرونیوم در چند نمونه روزمره
| نمونه محلول | pH تقریبی | غلظت یون هیدرونیوم (mol/L) | وضعیت پایداری |
|---|---|---|---|
| آب خالص | 7.0 | 1×10⁻⁷ | پایدار و خنثی |
| شیر تازه | 6.5 | 3.16×10⁻⁷ | پایدار |
| شیر ترش شده | 5.0 | 1×10⁻⁵ | ناپایدار |
| محلول اسید استیک (سرکه) | 3.0 | 1×10⁻³ | بسیار اسیدی |
این جدول نشان میدهد که حتی تغییرات کوچک در pH، میتواند غلظت یون هیدرونیوم را چندین برابر کند و پایداری ماده را تحت تأثیر قرار دهد.
دو نوع رسانایی در شیمی؛ الکترونی و یونی
رسانایی الکتریکی در مواد میتواند از دو مسیر اصلی انجام شود: انتقال الکترونها یا انتقال یونها. در رسانایی الکترونی، بارهای منفی آزاد در شبکه بلوری حرکت میکنند. در رسانایی یونی، جابهجایی یونهای مثبت و منفی عامل انتقال جریان است.
شناخت این دو نوع رسانایی برای دانشآموزان ضروری است، چون توضیح میدهد چرا برخی مواد جامد مانند فلزها در هر شرایطی رسانا هستند، اما بعضی مواد فقط زمانی جریان برق را عبور میدهند که به شکل محلول آبی یا مذاب باشند.
رسانایی الکترونی با مثال فلزها و گرافیت
فلزهایی مانند مس، آلومینیوم و آهن، رسانایی بالایی دارند چون الکترونهای لایه آخر اتمهایشان آزادانه در شبکه فلزی حرکت میکنند. این الکترونهای آزاد یا «گاز الکترونی» بدون نیاز به تغییر حالت ماده، جریان برق را انتقال میدهند.
گرافیت نیز با وجود اینکه یک غیرفلز است، رسانایی الکترونی دارد. علت آن وجود الکترونهای آزاد در پیوندهای π لایههای کربن است که میتوانند در امتداد صفحات گرافیت جابهجا شوند. همین ویژگی باعث میشود مغز مداد، که از گرافیت ساخته شده، بتواند جریان برق را عبور دهد.
رسانایی یونی در محلولهای آبی
در رسانایی یونی، بار الکتریکی از طریق حرکت یونهای مثبت و منفی در محلول یا مذاب منتقل میشود. این نوع رسانایی در موادی دیده میشود که هنگام حل شدن در آب یا ذوب شدن، به یونهای آزاد تجزیه میشوند.
برای مثال، در محلول آبی کلرید سدیم، یونهای Na⁺ و Cl⁻ آزادانه حرکت میکنند. وقتی دو الکترود به این محلول متصل میشوند، یونهای مثبت به سمت الکترود منفی و یونهای منفی به سمت الکترود مثبت حرکت میکنند و جریان برق برقرار میشود. این همان دلیلی است که به این مواد «الکترولیت» گفته میشود.
جدول مقایسه رسانایی الکترونی و رسانایی یونی
| ویژگی | رسانایی الکترونی | رسانایی یونی |
|---|---|---|
| عامل انتقال بار | الکترونهای آزاد | یونهای مثبت و منفی |
| نمونه مواد | فلزها (مس، آلومینیوم، آهن)، گرافیت | محلولهای آبی نمکها، اسیدها و بازها |
| حالت رسانایی | در حالت جامد و مذاب | فقط در حالت محلول آبی یا مذاب |
| تغییر شیمیایی ماده | در حین رسانایی تغییر شیمیایی ایجاد نمیشود | ممکن است واکنشهای شیمیایی (مانند الکترولیز) رخ دهد |
| سرعت پاسخ به جریان | بسیار سریع | کندتر از رسانایی الکترونی |
چطور محلولها را به الکترولیت و غیرالکترولیت دستهبندی میکنیم؟
محلولها را بر اساس توانایی آنها در عبور دادن جریان برق به دو دسته اصلی تقسیم میکنند: الکترولیت و غیرالکترولیت. معیار این تقسیمبندی، حضور یونهای آزاد در محلول است. اگر محلول حاوی یونهای مثبت و منفی باشد که بتوانند در آب آزادانه حرکت کنند، رسانا بوده و یک محلول الکترولیت محسوب میشود.
برای مثال، سدیم کلرید جامد رسانا نیست، اما زمانی که در آب حل میشود، به یونهای Na⁺ و Cl⁻ تجزیه میشود. این یونها عامل انتقال جریان برق در محلول هستند، به همین دلیل محلول آبی کلرید سدیم یک الکترولیت است.
در مقابل، موادی مانند شکر یا اتانول هنگام حل شدن در آب به یون تجزیه نمیشوند. آنها به شکل مولکولهای کامل در آب پخش میشوند و هیچ یون آزادی برای انتقال بار وجود ندارد. این محلولها غیرالکترولیت نامیده میشوند و رسانایی الکتریکی ندارند.
جدول مقایسه الکترولیت و غیرالکترولیت
| ویژگی | الکترولیت | غیرالکترولیت |
|---|---|---|
| حضور یونهای آزاد | دارد | ندارد |
| توانایی عبور جریان برق | رسانا | نارسانا |
| نمونه مواد | نمک طعام (NaCl)، اسید هیدروکلریک، سدیم هیدروکسید | شکر (C₁₂H₂₂O₁₁)، اتانول (C₂H₅OH) |
| رفتار در آب | تجزیه به یونهای مثبت و منفی | باقی ماندن به صورت مولکول کامل |
| کاربردها | الکترولیز، باتریها، فرایندهای شیمیایی صنعتی | محلولهای غذایی، حلالهای آلی |
رسانایی محلولهای اسیدی و ارتباط آن با قدرت اسید
رسانایی محلولهای اسیدی مستقیماً به تعداد یونهای هیدرونیوم موجود در آنها بستگی دارد. هرچه تعداد این یونها بیشتر باشد، توانایی محلول در انتقال جریان برق بیشتر خواهد بود. به همین دلیل، رسانایی الکتریکی میتواند بهعنوان یک معیار غیرمستقیم برای سنجش قدرت اسید مورد استفاده قرار گیرد.
اسیدهایی که در آب بهطور کامل یونش پیدا میکنند، غلظت بالایی از یون هیدرونیوم (H₃O⁺) تولید میکنند. این یونها در محلول آزادانه حرکت کرده و بار الکتریکی را انتقال میدهند. به همین دلیل محلولهای این اسیدها رسانایی بسیار بالایی دارند. در مقابل، اسیدهای ضعیف تنها بخشی از مولکولهای خود را به یون تبدیل میکنند و همین باعث میشود تعداد یونهای موجود کمتر و رسانایی کاهش یابد.
در آزمایشگاه، با اندازهگیری رسانایی محلولهای اسیدی میتوان تشخیص داد که آیا اسید مورد نظر قوی است یا ضعیف. این روش بهخصوص زمانی مفید است که بخواهیم بدون محاسبه مستقیم pH، به قدرت نسبی اسید پی ببریم.
چرا اسید قوی رسانایی بیشتری دارد؟
اسید قوی، مانند HCl یا HNO₃، هنگام حل شدن در آب تقریباً تمام مولکولهای خود را به یون تبدیل میکند. این فرآیند «یونش کامل» نام دارد. در این شرایط، تعداد یونهای هیدرونیوم و یونهای منفی متناظر (مثل Cl⁻ یا NO₃⁻) بسیار زیاد است.
این تراکم بالای یونها باعث میشود که جریان برق در محلول بهسرعت منتقل شود. در حقیقت، رسانایی بالای اسید قوی نتیجه مستقیم تعداد زیاد حاملهای بار در محلول است. حتی کاهش جزئی غلظت اسید قوی، تأثیر قابلتوجهی بر رسانایی خواهد داشت زیرا تعداد یونها مستقیماً با غلظت تغییر میکند.
از دیدگاه صنعتی، این ویژگی برای کنترل فرایندهایی که نیاز به محیط بسیار رسانا دارند اهمیت زیادی دارد؛ مثل برخی واکنشهای الکتروشیمیایی یا مراحل خالصسازی مواد.
مقایسه هیدروکلریک اسید و هیدروفلوئوریک اسید
هیدروکلریک اسید (HCl) نمونهای کلاسیک از یک اسید قوی است. در محلول آبی، تقریباً تمام مولکولهای HCl به یونهای H₃O⁺ و Cl⁻ تبدیل میشوند. این امر باعث ایجاد رسانایی بالا و رفتار قابل پیشبینی در محاسبات شیمیایی میشود.
در مقابل، هیدروفلوئوریک اسید (HF) یک اسید ضعیف است. مولکولهای HF به دلیل پیوند هیدروژنی قوی بین H و F و تمایل کمتر به جدا شدن پروتون، تنها تا حدی یونش پیدا میکنند. در محلولی با غلظت مساوی HCl و HF، غلظت یون هیدرونیوم HF بسیار کمتر است، بنابراین رسانایی آن هم پایینتر خواهد بود.
این تفاوت نهتنها از نظر نظری مهم است، بلکه در آزمایش عملی نیز بهوضوح دیده میشود. اندازهگیری رسانایی محلولهای این دو اسید بهراحتی نشان میدهد که HCl بهمراتب رساناتر از HF است، حتی اگر شرایط دما و غلظت برای هر دو یکسان باشد.
یونش اسیدها در آب و معادلههای واکنش
وقتی یک اسید در آب حل میشود، میتواند به یونهای سازندهاش تجزیه شود. این فرایند را یونش اسید مینامند. در این فرآیند، یون هیدروژن (H⁺) از مولکول اسید جدا شده و به یک مولکول آب میپیوندد و یون هیدرونیوم (H₃O⁺) را تشکیل میدهد.
شدت یونش اسیدها به نوع اسید بستگی دارد. اسیدهای قوی مانند HCl در آب تقریباً به طور کامل یونش پیدا میکنند. این یعنی تقریباً همه مولکولهای اسید به یون هیدرونیوم و یون منفی متناظرشان تبدیل میشوند. معادله واکنش برای HCl چنین است:
HCl(aq) + H₂O(l) → H₃O⁺(aq) + Cl⁻(aq)
در مقابل، اسیدهای ضعیف مانند HF تنها بخشی از مولکولهایشان یونش پیدا میکند. این یعنی در محلول علاوه بر یونها، هنوز تعداد زیادی مولکول اسید دستنخورده وجود دارد. معادله یونش HF به شکل زیر نوشته میشود:
HF(aq) + H₂O(l) ⇌ H₃O⁺(aq) + F⁻(aq)
علامت ⇌ نشان میدهد که یونش HF کامل نیست و واکنش در دو جهت پیش میرود؛ بخشی از یونها دوباره به مولکول اسید تبدیل میشوند.
درک این معادلهها برای دانشآموز اهمیت زیادی دارد، چون پایهای برای فهم درجه یونش، درصد یونش و در نهایت قدرت اسید محسوب میشود. این موضوع بهخصوص در حل مسائل محاسباتی شیمی دوازدهم کاربرد فراوانی دارد.
درجه یونش و درصد یونش؛ تعریف، فرمول و مثال
یکی از روشهای سنجش میزان تجزیه یک اسید در آب، استفاده از درجه یونش است. درجه یونش نشان میدهد چه بخشی از مولکولهای اسید موجود در محلول به یونهای آزاد تبدیل شدهاند. این کمیت با نماد α (آلفا) نشان داده میشود و مقداری بین ۰ و ۱ دارد.
فرمول کلی درجه یونش به این صورت است:
در برخی منابع، به جای تعداد مولها از غلظت مولی گونهها استفاده میشود که همان نتیجه را میدهد.
برای بیان این میزان بهصورت درصد، از درصد یونش استفاده میشود که برابر است با درجه یونش ضربدر ۱۰۰. این دو کمیت کمک میکنند تا اسیدها را بر اساس میزان یونش در آب، به قوی یا ضعیف دستهبندی کنیم.
محاسبه درجه یونش با دادههای مسأله
فرض کنید محلول ۰٫۱ مولار یک اسید ضعیف داریم و در این محلول، غلظت یون هیدرونیوم برابر ۰٫۰۰۲ مولار اندازهگیری شده است. برای محاسبه درجه یونش:
بنابراین، درجه یونش این اسید برابر ۰٫۰۲ است. این یعنی تنها ۲٪ از مولکولهای اسید موجود در محلول به یون هیدرونیوم و یون منفی متناظر تبدیل شدهاند.
تبدیل درجه یونش به درصد یونش
برای تبدیل درجه یونش به درصد یونش، کافی است مقدار α را در ۱۰۰ ضرب کنیم:
درصد یونش = α × 100
با استفاده از مثال قبلی:
درصد یونش = 0.02 × 100 = 2%
این عدد به زبان ساده میگوید که از هر ۱۰۰ مولکول اسید موجود در محلول، تنها ۲ مولکول یونش پیدا کرده است. این روش، راهی سریع و قابل فهم برای مقایسه قدرت اسیدهاست و در حل مسائل شیمی دوازدهم بسیار پرکاربرد است.
دستهبندی اسیدها بر اساس میزان یونش
یکی از معیارهای مهم برای تقسیمبندی اسیدها، میزان یونش آنها در آب است. این معیار نشان میدهد چه مقدار از مولکولهای اسید هنگام حل شدن به یون هیدرونیوم و یون منفی متناظر تبدیل میشوند.
اسیدهای قوی تقریباً بهطور کامل یونش پیدا میکنند و درجه یونش آنها نزدیک به ۱ (یا ۱۰۰٪) است. در محلول این اسیدها، تعداد یونهای آزاد بسیار زیاد و تعداد مولکولهای تجزیهنشده بسیار کم است. هیدروکلریک اسید (HCl) و نیتریک اسید (HNO₃) نمونههایی از این گروه هستند.
اسیدهای ضعیف تنها بخشی از مولکولهایشان یونش پیدا میکند و درجه یونش آنها بسیار کمتر از ۱ است. در محلول این اسیدها، علاوه بر یونها، تعداد زیادی مولکول دستنخورده نیز وجود دارد. اسید استیک (CH₃COOH) و هیدروفلوئوریک اسید (HF) از نمونههای این دستهاند.
درک این دستهبندی به دانشآموز کمک میکند پیشبینی کند که هر اسید چه میزان رسانایی الکتریکی دارد، pH آن در محلول چقدر است و در واکنشهای شیمیایی چه رفتاری از خود نشان میدهد.
کاربرد مفاهیم رسانایی و یونش در حل مسائل شیمی دوازدهم
درک مفاهیم رسانایی الکتریکی و یونش اسیدها فقط برای یادگیری نظری نیست؛ این مفاهیم ابزار مهمی برای حل مسائل شیمی دوازدهم هستند. با دانستن اینکه رسانایی محلول به تعداد یونهای موجود بستگی دارد، میتوانید پیشبینی کنید یک محلول اسیدی یا بازی چقدر رساناست و چه رفتاری در مدار الکتریکی خواهد داشت.
در بخشهای محاسباتی، درجه یونش و درصد یونش به شما کمک میکند مقدار یون هیدرونیوم موجود در محلول را پیدا کنید. این دادهها میتوانند بهطور مستقیم برای محاسبه pH یا برای مقایسه قدرت اسیدها استفاده شوند. همچنین، آشنایی با دستهبندی اسیدها (قوی یا ضعیف) باعث میشود در مسائل تستی یا تشریحی سریعتر مسیر حل را تشخیص دهید.
مفاهیمی که از غلظت یون هیدرونیوم گرفته تا معادلههای یونش و مقایسه اسیدها آموختید، یک زنجیره منسجم را تشکیل میدهند. این زنجیره هم در تحلیل پدیدههای روزمره مثل ترش شدن شیر، کاربرد دارد و هم در حل دقیق مسائل امتحانی و کنکوری. تسلط بر این مبحث یعنی یک قدم بزرگ بهسوی درک عمیقتر شیمی و پاسخگویی سریعتر در آزمونها.


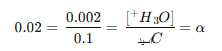



برای ارسال نظر لطفا ابتدا وارد حساب کاربری خود شوید. صفحه ورود و ثبت نام