ثابت تعادل و قدرت اسیدی در شیمی دوازدهم با آموزش مفهومی و تمرینهای کاربردی

- واکنش برگشتپذیر چیست و چه زمانی رخ میدهد؟
- سامانه تعادلی و ویژگیهای آن
- آزمایش شبیهسازی فرآیند تعادل با آب رنگی
- تعریف و مفهوم ثابت تعادل (K)
- ارتباط ثابت تعادل با قدرت اسیدی
- جدول ثابت یونش اسیدها و تحلیل آن
- کاربرد ثابت یونش در مسائل شیمی دوازدهم
- تمرینهای کاربردی برای تسلط بر ثابت تعادل و قدرت اسیدی
- جمعبندی و مرور نکات کلیدی ثابت تعادل و قدرت اسیدی
در بخش «ثابت تعادل و قدرت اسیدی» از فصل اول شیمی دوازدهم میآموزیم که همه واکنشها تا انتها پیش نمیروند. بعضی واکنشها به نقطهای میرسند که سرعت واکنش رفت و برگشت برابر میشود و مقدار مواد دیگر تغییر نمیکند؛ این حالت را تعادل شیمیایی مینامند. در این وضعیت، عددی به نام ثابت تعادل (K) جهت و میزان پیشرفت واکنش را نشان میدهد.
برای اسیدها، این مفهوم به شکل ثابت یونش اسید (Kₐ) بیان میشود و هرچه مقدار آن بزرگتر باشد، اسید قویتر خواهد بود. در این مطلب که در سایت تدریس شیمی متین هوشیار تهیه شده، با توضیح مفهومی و مثالهای ساده یاد میگیرید چگونه این اعداد را تفسیر کنید و از آنها برای مقایسه قدرت اسیدها استفاده کنید. همین مطالعه کوتاه میتواند روشن کند چرا دو اسید مشابه رفتار متفاوتی دارند و چطور میتوان قدرت آنها را پیشبینی کرد.
واکنش برگشتپذیر چیست و چه زمانی رخ میدهد؟
در شیمی، برخی واکنشها فقط در یک جهت پیش میروند و تا زمانی که مواد اولیه باقی بماند، متوقف نمیشوند. اما گروهی دیگر از واکنشها میتوانند هم در جهت تولید فرآورده و هم در جهت بازگشت به مواد اولیه رخ دهند. به این نوع واکنشها واکنش برگشتپذیر گفته میشود.
واکنش برگشتپذیر زمانی اتفاق میافتد که شرایط محیطی مانند دما، فشار یا غلظت، به واکنش اجازه دهند تا هم مسیر رفت و هم مسیر برگشت فعال باشد. در این وضعیت، واکنش تا جایی پیش میرود که سرعت واکنش رفت و برگشت برابر شود و تغییر خالص در مقدار مواد مشاهده نشود.
تعریف واکنش برگشتپذیر با مثال ساده
واکنش برگشتپذیر واکنشی است که در آن، مواد واکنشدهنده به فرآوردهها تبدیل میشوند و فرآوردهها نیز میتوانند دوباره به مواد اولیه برگردند. برای مثال، حل شدن گاز کربندیاکسید در نوشابه یک فرآیند برگشتپذیر است. در فشار بالا و دمای پایین، گاز به داخل مایع حل میشود، اما اگر در بطری باز شود و فشار کاهش یابد، گاز دوباره از محلول خارج میشود.
این ویژگی برگشتپذیری به ما کمک میکند بفهمیم که در بسیاری از فرآیندهای طبیعی و صنعتی، تعادل میان واکنش رفت و برگشت وجود دارد و با تغییر شرایط میتوان مسیر واکنش را کنترل کرد.
نقش شرایط فیزیکی و شیمیایی در برگشتپذیری واکنش
سرنوشت یک واکنش برگشتپذیر تا حد زیادی به شرایط فیزیکی و شیمیایی بستگی دارد. عواملی مانند دما، فشار، غلظت مواد و حتی وجود کاتالیزگر میتوانند سرعت مسیر رفت یا برگشت را تغییر دهند. برای مثال، در واکنش بین نیتروژن و هیدروژن برای تولید آمونیاک، افزایش فشار و استفاده از کاتالیزگر باعث تقویت مسیر رفت میشود، در حالی که کاهش فشار یا افزایش دما میتواند مسیر برگشت را تسریع کند.
در محیطهای آزمایشگاهی و صنعتی، درک این عوامل به شیمیدان اجازه میدهد شرایط را بهگونهای تنظیم کند که تعادل به نفع تولید فرآورده یا واکنشدهنده تغییر کند.
سامانه تعادلی و ویژگیهای آن
وقتی یک واکنش برگشتپذیر به نقطهای برسد که سرعت واکنش رفت و برگشت برابر شود، سامانه تعادلی شکل میگیرد. در این حالت، ظاهر واکنش بیحرکت به نظر میرسد، اما در واقع در مقیاس مولکولی، هر دو مسیر بهطور همزمان فعال هستند.
ویژگی مهم سامانه تعادلی این است که غلظت واکنشدهندهها و فرآوردهها با گذر زمان تغییر نمیکند، هرچند واکنشها همچنان ادامه دارند. این پایداری نسبی، شرایطی ایدهآل برای بررسی کمی واکنشها و محاسبه ثابت تعادل فراهم میکند.
چگونه واکنش رفت و برگشت همزمان انجام میشود؟
در سامانه تعادلی، مولکولهای واکنشدهنده در مسیر رفت به فرآورده تبدیل میشوند و همزمان مولکولهای فرآورده در مسیر برگشت دوباره به واکنشدهنده تغییر شکل میدهند. این تبادل مداوم باعث میشود که هیچگاه واکنش متوقف نشود، بلکه فقط نرخ تبدیل در هر دو مسیر برابر گردد.
برای مثال، در یک محلول اشباعشده از نمک طعام (NaCl) در آب، یونهای سدیم و کلرید از بلور جدا میشوند و همزمان یونها دوباره به بلور بازمیگردند. این وضعیت نمونهای ساده از واکنش همزمان رفت و برگشت است.
تفاوت مقدار واکنشدهندهها و فرآوردهها در حالت تعادل
در حالت تعادل، برابر بودن سرعت دو مسیر به این معنی نیست که مقدار واکنشدهندهها و فرآوردهها حتماً یکسان است. بسته به ماهیت واکنش و شرایط آن، ممکن است در تعادل، مقدار فرآوردهها بیشتر یا کمتر از واکنشدهندهها باشد.
برای نمونه، اگر ثابت تعادل یک واکنش بسیار بزرگ باشد، سامانه در حالت تعادل بیشتر حاوی فرآورده خواهد بود. برعکس، اگر ثابت تعادل کوچک باشد، غلظت واکنشدهندهها در تعادل بیشتر از فرآوردهها خواهد بود. این نکته نشان میدهد که تعادل به معنای «مقادیر برابر» نیست، بلکه به معنای «سرعتهای برابر» است.
آزمایش شبیهسازی فرآیند تعادل با آب رنگی
یکی از بهترین راهها برای فهمیدن مفهوم تعادل شیمیایی، انجام یک آزمایش ساده با آب رنگی است. این آزمایش نشان میدهد که چگونه مواد میتوانند بین دو ظرف جابهجا شوند و در نهایت به حالتی برسند که مقدار آنها در هر ظرف ثابت میماند، حتی اگر با هم برابر نباشند.
وسایل و مواد مورد نیاز
برای انجام این آزمایش، به وسایل ساده و در دسترس نیاز دارید:
- دو ظرف پلاستیکی با حجم تقریبی ۲ لیتر
- دو بشر ۱۰۰ و ۵۰ میلیلیتری
- دو استوانه مدرج ۱۰۰ میلیلیتری
- حدود یک لیتر آب مخلوط با چند قطره رنگ خوراکی
این وسایل امکان جابهجایی دقیق حجمهای مشخصی از محلول را فراهم میکنند و به شما کمک میکنند تغییرات را مرحلهبهمرحله مشاهده کنید.
مراحل انجام آزمایش و مشاهده نتیجه
- هر ظرف پلاستیکی را تا نصف با آب رنگی پر کنید.
- با استفاده از بشر یا استوانه مدرج، مقدار مشخصی محلول را از ظرف اول به ظرف دوم منتقل کنید.
- سپس همان مقدار محلول را از ظرف دوم به ظرف اول برگردانید.
- این جابهجایی را چندین بار تکرار کنید و تغییرات حجم و رنگ محلولها را در هر ظرف یادداشت کنید.
پس از چندین بار انتقال، خواهید دید که حجم و غلظت آب رنگی در هر ظرف، دیگر تغییر محسوسی ندارد.
تحلیل علمی مشاهدهها و ارتباط با مفهوم تعادل
این آزمایش نمونهای ساده از یک فرآیند برگشتپذیر است. در ابتدا، تفاوت رنگ و حجم در دو ظرف زیاد است، اما با ادامه جابهجاییها، اختلافها کمتر میشود تا جایی که شرایط هر دو ظرف پایدار میماند.
این پایداری به معنای توقف کامل جابهجایی نیست؛ بلکه در هر لحظه مقداری محلول از ظرف اول به دوم و همزمان از دوم به اول منتقل میشود. سرعت جابهجایی در هر دو جهت برابر است و سامانه به تعادل پویا رسیده است.
تعریف و مفهوم ثابت تعادل (K)
وقتی یک واکنش برگشتپذیر به حالت تعادل میرسد، نسبت خاصی بین غلظت فرآوردهها و واکنشدهندهها برقرار میشود. این نسبت که با نماد K نشان داده میشود، همان ثابت تعادل است.
ثابت تعادل یک کمیت بدون واحد یا با واحد مشخص (بسته به نوع واکنش) است که فقط به دمای سامانه وابسته است. مقدار K نشان میدهد که در حالت تعادل، کدام سمت واکنش غالب است؛ اگر K بزرگ باشد، مقدار فرآوردهها بیشتر است و اگر کوچک باشد، واکنشدهندهها بیشتر باقی میمانند.
فرمول ثابت تعادل و نحوه نوشتن آن
برای نوشتن فرمول ثابت تعادل، ابتدا باید معادله موازنهشده واکنش را داشته باشیم. سپس غلظت فرآوردهها را در توان ضرایب استوکیومتریشان ضرب کرده و حاصل را بر همین ترکیب برای واکنشدهندهها تقسیم میکنیم.
به عنوان مثال، برای واکنش:
aA+bB⇌cC+dD
فرمول K به صورت زیر نوشته میشود:
علامت [ ] به معنی غلظت تعادلی بر حسب مول بر لیتر است.
چرا مقدار K در دمای ثابت، تغییر نمیکند؟
ثابت تعادل حاصل نسبت غلظتهای تعادلی مواد است و این نسبت در دمای معین همواره ثابت باقی میماند، حتی اگر مقادیر اولیه واکنشدهندهها متفاوت باشد.
علت این پایداری، وابستگی K به انرژی آزاد گیبس واکنش در دمای مشخص است. تا زمانی که دما تغییر نکند، مقادیر غلظتها طوری تغییر میکنند که نسبت آنها (یعنی K) ثابت بماند.
آیا مقدار K به غلظت اولیه مواد بستگی دارد؟
خیر، مقدار K تنها به دما و ماهیت واکنش وابسته است. حتی اگر واکنش را با غلظتهای اولیه متفاوت آغاز کنید، پس از رسیدن به تعادل، نسبت غلظتهای فرآوردهها به واکنشدهندهها بر اساس همان مقدار ثابت K خواهد بود.
تغییر در غلظت اولیه فقط مسیر رسیدن به تعادل را تغییر میدهد، نه مقدار نهایی K را. این ویژگی، یکی از مهمترین دلایل کاربردپذیری K در پیشبینی رفتار سامانههای شیمیایی است.
ارتباط ثابت تعادل با قدرت اسیدی
در واکنشهای اسیدی، همان مفهوم ثابت تعادل نیز برقرار است، اما به شکل ویژهای تعریف میشود که ثابت یونش اسید یا Kₐ نام دارد. این ثابت نشان میدهد که یک اسید تا چه اندازه در آب یونش پیدا میکند و یون هیدرونیوم (H₃O⁺) تولید میکند.
شناخت ارتباط بین K و Kₐ به ما کمک میکند رفتار اسیدها را از نظر قدرت و میزان یونش پیشبینی کنیم. هرچه مقدار Kₐ بزرگتر باشد، اسید قویتر است و درصد بیشتری از مولکولهای آن به یون تبدیل میشوند.
تعریف ثابت یونش اسید (Kₐ) و تفاوت آن با K
ثابت یونش اسید، یک نوع خاص از ثابت تعادل است که فقط به واکنش یونش اسیدها در آب مربوط میشود. برای یک اسید HA در آب، واکنش به صورت زیر نوشته میشود:
HA + H2O ⇌ H3O+ + A–
فرمول Kₐ به شکل زیر است:
تفاوت K و Kₐ در این است که K برای هر واکنش برگشتپذیر بهطور کلی تعریف میشود، اما Kₐ مخصوص تعادل یونش اسیدها است.
رابطه بین مقدار Kₐ و قدرت اسید
قدرت اسید به میزان توانایی آن در تولید یون هیدرونیوم بستگی دارد. هرچه Kₐ بزرگتر باشد، غلظت یونهای H₃O⁺ در محلول بیشتر است و اسید قویتر محسوب میشود.
برای مثال، اسید کلریدریک (HCl) Kₐ بسیار بزرگی دارد و تقریباً به طور کامل یونش پیدا میکند، در حالی که اسید استیک (CH₃COOH) Kₐ کوچکی دارد و تنها بخش کمی از مولکولهایش یونش میشوند.
کاربرد pKₐ در مقایسه قدرت اسیدها
برای راحتی کار، معمولاً به جای Kₐ از pKₐ استفاده میشود که برابر با منفی لگاریتم Kₐ است:
PKa = -log (Ka)
رابطه معکوس بین pKₐ و قدرت اسید وجود دارد؛ هرچه pKₐ کوچکتر باشد، اسید قویتر است. این مفهوم در مقایسه سریع قدرت اسیدها، طراحی واکنشهای شیمیایی و حتی پیشبینی جهت تعادل کاربرد فراوان دارد.
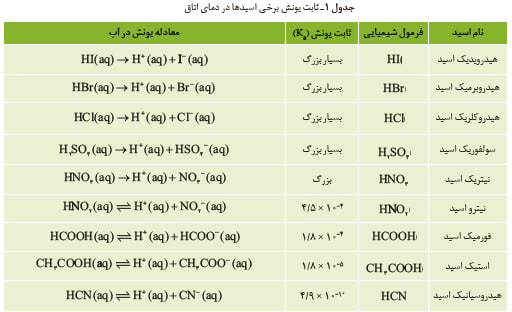
جدول ثابت یونش اسیدها و تحلیل آن
در کتاب شیمی دوازدهم، جدولی از مقدار Kₐ برای چند اسید مهم ارائه شده است. این جدول به شما کمک میکند تا قدرت اسیدها را نهتنها به صورت کیفی، بلکه به شکل کمی هم مقایسه کنید. هر عدد Kₐ نشان میدهد که چه مقدار از اسید در محلول آب یونش پیدا میکند و به یونهای هیدرونیوم و باز مزدوج تبدیل میشود.
بررسی جدول ثابت یونش، روشی سریع و دقیق برای پیشبینی رفتار اسیدها در واکنشهای شیمیایی است. به عنوان مثال، میتوان فهمید که کدام اسید در محلول، یونهای بیشتری تولید میکند و در نتیجه واکنشپذیری بالاتری دارد.
چرا اسیدهای قوی Kₐ بزرگتری دارند؟
عدد Kₐ نشاندهنده تمایل اسید به یونش در آب است. در اسیدهای قوی، این تمایل بسیار زیاد است و تقریباً تمام مولکولها به یون هیدرونیوم و باز مزدوج تبدیل میشوند. به همین دلیل، غلظت یونهای تولید شده در حالت تعادل بالا و در نتیجه Kₐ بزرگ است.
برعکس، در اسیدهای ضعیف، بخش کوچکی از مولکولها یونش پیدا میکنند. این باعث میشود که غلظت یونهای H₃O⁺ کم و مقدار Kₐ کوچک باشد.
مقایسه چند اسید مهم در جدول کتاب درسی
در جدول کتاب، مقادیر Kₐ برای اسیدهایی مانند هیدرویدیک اسید (HI)، هیدروکلریک اسید (HCl)، نیتریک اسید (HNO₃)، سولفوریک اسید (H₂SO₄)، فورمیک اسید (HCOOH) و استیک اسید (CH₃COOH) آمده است.
مقایسه این مقادیر نشان میدهد که اسیدهایی مثل HI و HCl، ثابت یونش بسیار بزرگی دارند و در محلول تقریباً بهطور کامل یونش میشوند. در مقابل، اسیدهایی مانند استیک اسید، Kₐ کوچکتری دارند و بخش کمی از مولکولهای آنها به یون تبدیل میشوند. این اختلاف، به دانشآموز کمک میکند تا رفتار اسیدها را در واکنشها پیشبینی کند.
کاربرد ثابت یونش در مسائل شیمی دوازدهم
ثابت یونش اسید (Kₐ) فقط یک عدد در جدول نیست؛ این کمیت ابزاری قدرتمند برای حل مسائل و پیشبینی رفتار اسیدها در شرایط مختلف است. با استفاده از مقدار Kₐ، میتوان قدرت اسیدها را مقایسه کرد، درصد یونش را محاسبه نمود و حتی تغییرات غلظت یون هیدرونیوم را پیشبینی کرد.
در تمرینهای شیمی دوازدهم، این مفهوم اغلب بهصورت مستقیم یا غیرمستقیم به کار میرود. یادگیری نحوه استفاده از Kₐ به شما کمک میکند تا پاسخ بسیاری از پرسشهای مفهومی و محاسباتی را سریعتر و دقیقتر پیدا کنید.
تعیین قویتر بودن اسید با دادههای Kₐ
برای مقایسه قدرت دو اسید، کافی است مقدار Kₐ هر کدام را در یک دمای ثابت بررسی کنید. هرچه Kₐ یک اسید بزرگتر باشد، آن اسید قویتر است و درصد بیشتری از مولکولهای آن به یون هیدرونیوم تبدیل میشوند.
به عنوان مثال، اگر Kₐ اسید A برابر ۱٫۸×۱۰⁻⁵ و Kₐ اسید B برابر ۴٫۵×۱۰⁻⁷ باشد، اسید A قویتر است زیرا تمایل بیشتری به یونش دارد و یونهای بیشتری در محلول تولید میکند.
مثال باران اسیدی و تفاوت با باران معمولی
باران اسیدی معمولاً حاوی اسیدهای قویتری مانند نیتریک اسید (HNO₃) و سولفوریک اسید (H₂SO₄) است که Kₐ بالاتری دارند. این اسیدها باعث میشوند غلظت یون هیدرونیوم در قطرات باران بیشتر شود و pH باران کاهش پیدا کند.
در مقابل، باران معمولی بیشتر به دلیل وجود کربنیک اسید (H₂CO₃) اسیدی میشود که Kₐ بسیار کوچکی دارد (حدود ۴٫۵×۱۰⁻⁷). به همین دلیل، pH آن نسبت به باران اسیدی بالاتر است و اثرات مخرب کمتری بر محیطزیست دارد.
تمرینهای کاربردی برای تسلط بر ثابت تعادل و قدرت اسیدی
یادگیری مفاهیم «ثابت تعادل» و «قدرت اسیدی» زمانی کامل میشود که بتوانید آنها را در قالب حل تمرین به کار ببرید. حل مسائل نهتنها باعث تثبیت آموختهها میشود، بلکه سرعت و دقت شما را در امتحانات نهایی و کنکور افزایش میدهد. در ادامه، دو نمونه تمرین مهم را میبینید که به درک بهتر این مفاهیم کمک میکنند.
نمونه سؤال محاسبه K با دادههای تعادلی
صورت سؤال:
در یک واکنش برگشتپذیر ساده:
A⇌B
غلظت تعادلی A برابر ۰٫۲ mol/L و غلظت تعادلی B برابر ۰٫۸ mol/L است. مقدار K را محاسبه کنید.
راه حل:
K = [B] ÷ [A] = 0.8 ÷ 0.2 = 4
نتیجه: مقدار K برابر ۴ است، که نشان میدهد در حالت تعادل، فرآوردهها غالب هستند.
نمونه سؤال مقایسه قدرت اسید با Kₐ دادهشده
صورت سؤال:
دو اسید X و Y در دمای ثابت، به ترتیب دارای Kₐ برابر ۱٫۵×۱۰⁻³ و ۲٫۸×۱۰⁻⁶ هستند. کدام اسید قویتر است و چرا؟
راهحل:
هرچه مقدار Kₐ بزرگتر باشد، اسید قویتر است زیرا درصد یونش آن بیشتر است. از آنجا که Kₐ اسید X بزرگتر از اسید Y است، اسید X قویتر است.
نتیجه: اسید X با تمایل بیشتر به یونش، غلظت بیشتری از یون هیدرونیوم تولید میکند و در نتیجه قدرت اسیدی بالاتری دارد.
جمعبندی و مرور نکات کلیدی ثابت تعادل و قدرت اسیدی
در این مطلب، با مفهوم واکنش برگشتپذیر و شرایط ایجاد سامانه تعادلی آشنا شدیم. فهمیدیم که در حالت تعادل، سرعت واکنش رفت و برگشت برابر است اما مقدار واکنشدهندهها و فرآوردهها لزوماً یکسان نیست.
سپس تعریف ثابت تعادل (K) و ثابت یونش اسید (Kₐ) را بررسی کردیم و دیدیم که Kₐ، شاخصی برای سنجش قدرت اسید است. مقدار بزرگتر Kₐ نشاندهنده اسید قویتر و درصد یونش بیشتر است. همچنین یاد گرفتیم که pKₐ ابزاری ساده برای مقایسه سریع قدرت اسیدها است.
در ادامه، جدول Kₐ اسیدهای مختلف را تحلیل کردیم و کاربرد آن را در مسائل شیمی، از جمله مقایسه اسیدها و بررسی باران اسیدی، دیدیم. در پایان نیز با چند تمرین محاسباتی، مهارت خود را در استفاده از K و Kₐ تقویت کردیم.
یادگیری این مفاهیم، شما را در حل مسائل شیمی دوازدهم و درک عمیقتر واکنشهای اسیدی–بازی یاری میکند و پایهای محکم برای موفقیت در امتحانات فراهم میسازد.

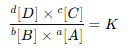



برای ارسال نظر لطفا ابتدا وارد حساب کاربری خود شوید. صفحه ورود و ثبت نام